
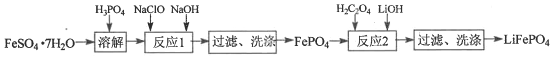
【题目】FePO4是一种难溶于水的白色固体,可作金属防腐剂,也可用于制备电动汽车电池的正极材料 LiFePO4。实验室利用FeSO4·7H2O和H3PO4(弱酸)制备FePO4、 LiFePO4流程如下图:
回答下列问题:
(1)“溶解”时H3PO4不宜过量太多的原因是_________________________________。
(2)①洗涤FePO4沉淀的操作是__________________________________________________。
②若经多次洗涤后所得“FePO4”仍呈棕色,则“FePO4”最可能混有的杂质是___________。
(3)“反应1”时总反应的离子方程式是:_________________________________。
(4)“反应2”时总反应的化学方程式是:2LiOH+6H2C2O4+2FePO4=2LiFePO4+ 7CO2+ 5X+7H2O,其中X的化学式为___________;每生成1 mol LiFePO4,该反应转移___________mole-。
(5)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是:LiFePO4+C6![]() Li1- xFePO4+LixC6,其放电时工作原理如图所示。则:
Li1- xFePO4+LixC6,其放电时工作原理如图所示。则:
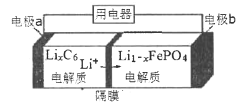
充电时,a极的电极名称为___________;放电时,b极的电极反应式为:_________________________________。
【答案】防止后续反应中消耗NaOH,浪费原料 向漏斗中加入蒸馏水刚好浸没沉淀,待水流尽,重复操作2﹣3次 Fe(OH)3 2 Fe2+ + ClO-+ 2H3PO4 + 4 OH-=2FePO4↓+ Cl-+ 5H2O CO 3.5 阴极 Li1-xFePO4 + xLi+ + xe-=LiFePO4
【解析】
(1)为了防止后续反应中消耗过多的NaOH,浪费原料,故“溶解”时H3PO4不宜过量太多;
(2)①洗涤FePO4沉淀的操作是向漏斗中加入蒸馏水刚好浸没沉淀,待水流尽,重复操作2﹣3次;
②Fe(OH)3是一种红褐色的固体,若经多次洗涤后所得“FePO4”仍呈棕色,则“FePO4”最可能混有的杂质是Fe(OH)3;
(3)“反应1”时亚铁离子被次氯酸钠氧化,碱性条件下铁离子与磷酸根离子反应产生磷酸铁沉淀,总反应的离子方程式是2 Fe2+ + ClO﹣+ 2H3PO4 + 4 OH﹣=2FePO4↓+ Cl﹣+ 5 H2O;
(4)根据质量守恒可知,反应2LiOH + 6H2C2O4 + 2FePO4=2LiFePO4 + 7CO2 + 5X +7H2O右边还少了5个C、5个O,X的计量数为5,则X的化学式为CO;反应中碳元素由+3价降为+2价、铁元素由+3价降为+2价;碳元素由+3价升为+4价,根据氧化还原反应原理,每生成2molLiFePO4,则生成7mol CO2,转移7mole-,故每生成1molLiFePO4,该反应转移3.5mole-;
(5)原电池中阳离子向正极移动,锂离子向电极b移动,则电极b为正极,充电时b电极为阳极、a为阴极;
放电时,正极b极上Li1﹣xFePO4得电子产生LiFePO4,电极反应式为Li1﹣xFePO4 + xLi+ + xe﹣=LiFePO4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用图示装置进行下列实验,能达到实验目的的是
溶液a | 固体b | 溶液c | 实验目的:验证 |
| |
A | 浓硝酸 | NaHCO3 | Na2SiO3 | 非金属性:N>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓盐酸 | CaCO3 | NaAlO2 | 酸性:HCl>H2CO3>Al(OH)3 | |
D | 浓氨水 | CaO | 酚酞溶液 | NH3·H2O是弱碱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
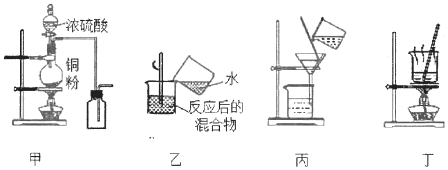
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾的化合物广泛存在于自然界中。回答下列问题:
(l)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_________形象化描述。
(2)钾的焰色反应为_____色,发生焰色反应的原因是__________________________________。
(3)叠氮化钾(KN3)晶体中,含有的共价键类型有_____________,N3-的空间构型为__________。
(4)CO能与金属K和Mn形成配合物K[Mn(CO)5],Mn元素基态原子的价电子排布式为______________。
(5)原子坐标参数可表示晶饱内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(l,0,0),则C原子的坐标参数为_____________。

(6)钾晶体的晶胞参数为a pm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为____________pm,晶体钾的密度计算式是_____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知存在离子反应3S+6OH-=2S2-+SO32-+3H2O,关于该反应的说法正确的是
A. 该反应属于复分解反应
B. 该反应氢氧根离子作氧化剂
C. 该反应中氧化剂与还原剂的质量为2∶1
D. 每生成2个S2-反应转移的电子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.按要求完成下列问题:
(1)甲基的电子式__________;
(2) ![]() 含有的官能团的名称为__________;
含有的官能团的名称为__________;
II.某有机物的结构简式为 ![]() ,据此填写下列的空。
,据此填写下列的空。
(1)该物质苯环上一氯代物有__________种;
(2)lmol该物质和溴水混合,消耗Br2的物质的量为__________mol;
(3)lmol该物质和H2加成需H2__________mol。
III.![]() 与一定量的Br2发生加成反应,生成的产物可能是__________。
与一定量的Br2发生加成反应,生成的产物可能是__________。
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极,②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
A. ①③②④B. ①③④②C. ③④②①D. ③①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com