



科目:高中化学 来源:不详 题型:实验题
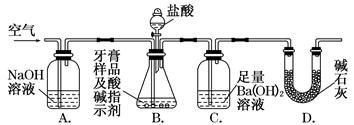
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
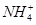 + [AI(OH)4]— ===
+ [AI(OH)4]— ===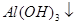
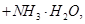 向含有等物质的量的
向含有等物质的量的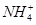 、
、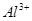 、
、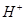 的混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:
的混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应: 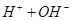 ===
===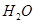 ②
②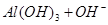 ===[AI(OH)4]—③
===[AI(OH)4]—③ ===
===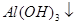
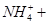
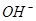 ===
===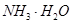 发生反应的先后顺序正确的是
发生反应的先后顺序正确的是A.①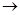 ④ ④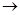 ③ ③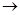 ② ② | B.①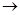 ③ ③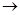 ② ②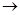 ④ ④ | C.①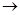 ③ ③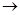 ④ ④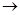 ② ② | D.①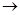 ② ② ③ ③ ④ ④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.11.20L | B.15.68L | C.22.40L | D.31.36L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
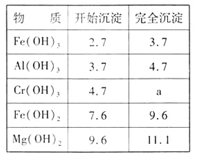
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com