
 甲、乙、丙、丁和X五种元素在周期表中的位置关系如图,其中X为金属元素,则甲乙丙丁中一定为金属元素的是( )
甲、乙、丙、丁和X五种元素在周期表中的位置关系如图,其中X为金属元素,则甲乙丙丁中一定为金属元素的是( ) 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 原子序数 | 1 | 7 | 11 | 16 | 17 |
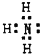
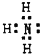


查看答案和解析>>
科目:高中化学 来源: 题型:


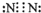
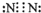
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省宁德市高三1月单科质量检查考试化学试卷(解析版) 题型:填空题
Q、W、X、Y、Z五种短周期元素,原子序数依次增大。Q在元素周期表中原子半径最小,W元素最高正价与最低负价代数和为0;Y与Q同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)X、Z简单离子半径较大是??????????????? (用离子符号表示)。
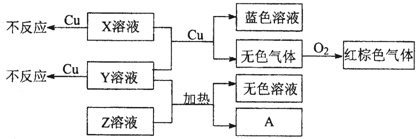
(2)由这五种元素中的若干种组成的化合物甲、乙、丙、丁在水溶液中有如下转化关系: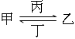 ,其中丙是溶于水显酸性的气体,丁是强碱。
,其中丙是溶于水显酸性的气体,丁是强碱。
①若乙常作为焙制糕点的发酵粉,则乙含有的化学键类型有????????????????????? ;乙溶液中阳离子浓度之和??????? 阴离子浓度之和(填“>”、“=”或“<”)。
②若乙是难溶物,甲溶液与过量的丙生成乙的离子方程式为:???????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2008-2009学年北京四中高一(下)期末化学试卷(解析版) 题型:填空题
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 原子序数 | 1 | 7 | 11 | 16 | 17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com