
【题目】浑浊的泥水是复杂的分散系,过滤后可以得到胶体。下列描述错误的是( )
A.浊液是一种不稳定的分散系
B.可以用“丁达尔”效应区别胶体和溶液
C.过滤得到的胶体可能带负电荷
D.河流在入海口形成“三角洲”,因为发生了胶体的凝聚
科目:高中化学 来源: 题型:
【题目】氧化还原反应发生在同种元素之间的是( )
A. Zn+2HCl![]() ZnCl2+H2↑
ZnCl2+H2↑
B. 2H2S+SO2![]() 3S↓+2H2O
3S↓+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已知下列物质燃烧的化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ.mol-1。
在此条件下,下列叙述正确的是
A. C(s)+2H2(g)=CH4(g) △H=+75.5kJ·mol-1
B. CH4(g)+O2(g)=C(s)+2H2O(g) △H=-1283.5kJ.mol-1
C. 1molH2(g)和3molCH4(g)燃烧共放热2956kJ.mol-1
D. 相同质量的H2和CH4充分燃烧时,H2放出的热量约等于CH4放出的热量的2.57倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物由碳、氢、氧三种元素组成,其红外光谱图只有C—H键、O—H键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是
A. CH3CH2OCH3 B. CH3CH(OH)CH3 C. CH3CH2CH2CH2OH D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_____________________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用树状分类法对下列10种物质进行分类
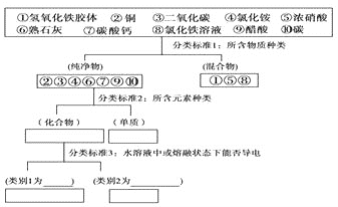
其中,强电解质有:________、弱电解质有:________,写出③的水化物的电离方程式:________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。

几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为________,滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是_________。“调节pH”除去的离子主要有Al3+和_________。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时漫出率下降的原因是___________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 ![]() Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为____________。
(6)工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。

①电解槽中阳极的电极反应式是__________________。
②向LiOH溶液中加入稍过量的NH4HCO3溶液时,发生反应的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com