
【题目】运用树状分类法对下列10种物质进行分类
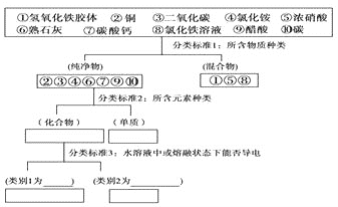
其中,强电解质有:________、弱电解质有:________,写出③的水化物的电离方程式:________.
【答案】 ④、⑥、⑦ ⑨ H2CO3H++HCO3-
【解析】
在水溶液或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下均不导电的化合物是非电解质;在水溶液中完全电离成离子的电解质属于强电解质,发生部分电离的电解质属于弱电解质,据此分析。
在水溶液或熔融状态下能导电的化合物是电解质,如④、⑥、⑦、⑨,在水溶液中完全电离成离子的电解质属于强电解质,如④、⑥、⑦;在溶液中发生部分电离的电解质属于弱电解质如⑨;③二氧化碳与水反应生成碳酸,碳酸在溶液中发生两步电离,以第一步为主,碳酸的电离方程式为:H2CO3H++HCO3-,
因此,本题正确答案是:④、⑥、⑦;⑨;H2CO3H++HCO3-。


科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
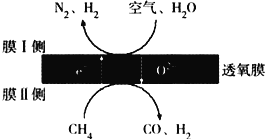
①起还原作用的物质是_________________________。
②膜I侧所得气体![]() =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________

A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0molN2和23.0molH2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。
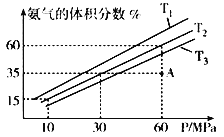
①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浑浊的泥水是复杂的分散系,过滤后可以得到胶体。下列描述错误的是( )
A.浊液是一种不稳定的分散系
B.可以用“丁达尔”效应区别胶体和溶液
C.过滤得到的胶体可能带负电荷
D.河流在入海口形成“三角洲”,因为发生了胶体的凝聚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖被授予来自美国和日本的三位科学家,以表彰他们在“Y离子”电池研发领域作出的贡献。Y元素在海水和盐湖中含量较为丰富,Y元素是( )
A.钠B.碘C.溴D.锂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为 ( )
A. AgCl>AgI>Ag2S B. AgCl2S
C. AgCl=AgI=Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com