
【题目】向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为 ( )
A. AgCl>AgI>Ag2S B. AgCl2S
C. AgCl=AgI=Ag2S D. AgI>AgCl>Ag2S
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】运用树状分类法对下列10种物质进行分类
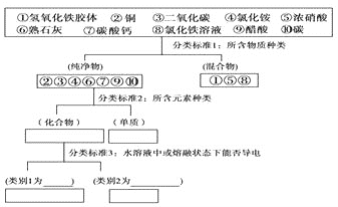
其中,强电解质有:________、弱电解质有:________,写出③的水化物的电离方程式:________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。

几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为________,滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是_________。“调节pH”除去的离子主要有Al3+和_________。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时漫出率下降的原因是___________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 ![]() Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
Co(HA2)2+2H+。则反萃取过程加入的试剂X是_____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为____________。
(6)工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。

①电解槽中阳极的电极反应式是__________________。
②向LiOH溶液中加入稍过量的NH4HCO3溶液时,发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关人体中水和无机盐的叙述,错误的是 ( )
A. 血浆中含有水 B. 自由水是细胞内的良好的溶剂
C. 血红蛋白中含有铁元素 D. 细胞中一定没有无机盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2g甲醛(CH2O)气体溶于6g冰醋酸中,再加入4g果糖得混合物甲;另取5g甲酸甲酯(HCOOCH3)和9g葡萄糖相混合,得混合液乙;然后将甲和乙两种混合液再按7:4的质量比混合得丙,则丙中碳元素的质量分数是
A. 20% B. 35% C. 40% D. 55%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Cl2(HCl) | 饱和食盐水 | 洗气 |
B | NaBr溶液(NaI) | Cl2 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | HNO3溶液(H2SO4) | BaCl 2溶液 | 过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO,稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是 ( )
A. H2SO4 B. CuSO4 C. CH3COONa D. Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com