
 在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )
在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )| A、△H<0,△S>0 |
| B、△H>0,△S<0 |
| C、△H>0,△S>0 |
| D、△<0,△S<0 |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 ,除生成
,除生成 外,另一种产物是
外,另一种产物是查看答案和解析>>
科目:高中化学 来源: 题型:

| O3 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、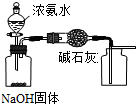 用装置制取干燥纯净的NH3 |
B、 用装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置可证明非金属性Cl>C>Si |
D、 装置向左推动针筒活塞可检验该装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NH3在5s内的平均速度为
| ||
| B、达到平衡时NH3的分解率为40% | ||
C、N2的平衡浓度为
| ||
| D、反应开始时与平衡时的压强比为5:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、家中发生天然气泄漏,不能在室内用电话报警 |
| B、洁厕剂和漂白精不能混合使用,否则易产生有毒气体 |
| C、双氧水可用于杀菌、消毒、漂白 |
| D、明矾既可用于净水,又可杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量Ba( OH)2溶液加入明矾溶液 |
| B、过氧化钠投入到FeC12溶液中 |
| C、向NaAlO2溶液中通入过量CO2 |
| D、向饱和Na2CO3溶液中通入过量CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com