
����Ŀ����֪���ȼ��a g ��Ȳ����ʱ����1mol������̼�����Һ̬ˮ�����ų�����bkJ������Ȳȼ�յ��Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.C2H2(g)+ ![]() O2(g)=2CO2(g)+H2O(g) ��H=-2b kJ/mol
O2(g)=2CO2(g)+H2O(g) ��H=-2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ��H=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l) ��H=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ��H=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ��H=+4b kJ/mol

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() N2(g)+
N2(g)+![]() H2(g)=N(g)+3H(g) ��H1=+akJ��mol-1��
H2(g)=N(g)+3H(g) ��H1=+akJ��mol-1��
N(g)+3H(g)=NH3(g) ��H2=-bkJ��mol-1��
NH3(g)=NH3(l) ��H3=-ckJ��mol-1
��д��N2(g)��H2(g)��Ӧ����Һ�����Ȼ�ѧ����ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����A��B�����2L���ܱ������У��������з�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)����2min����D��Ũ��Ϊ0.5mol/L��c(A)��c(B)��3��5����C��ʾ��ƽ������v(C)��0.25mol��L1��min1������˵����ȷ����
xC(g)+2D(g)����2min����D��Ũ��Ϊ0.5mol/L��c(A)��c(B)��3��5����C��ʾ��ƽ������v(C)��0.25mol��L1��min1������˵����ȷ����
A. ��Ӧ����v(B)��0.25 mol��L��1��min��1
B. �÷�Ӧ����ʽ��x��1
C. 2minʱ��A�����ʵ���Ϊ1.5mol
D. 2minʱ��A��ת����Ϊ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������
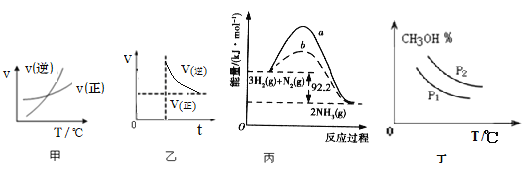
A.��ͼ�ױ�ʾ�ķ�Ӧ�������¶ȱ仯�Ĺ�ϵ��֪�÷�Ӧ����H��0
B.ͼ�ұ�ʾ��ӦNH2COONH4(s) ![]() 2NH3(g)+CO2(g)�ﵽƽ�������ѹǿ����Ӧ���ʺ�ʱ��Ĺ�ϵ���ﵽ��ƽ�����Ũ�Ȳ��䣬ѹǿҲ����
2NH3(g)+CO2(g)�ﵽƽ�������ѹǿ����Ӧ���ʺ�ʱ��Ĺ�ϵ���ﵽ��ƽ�����Ũ�Ȳ��䣬ѹǿҲ����
C.ͼ���������г��� 1 mol N2��3 mol H2����ַ�Ӧ��ų����� 92.2 kJ
D.ͼ���ɱ�ʾ�ڲ�ͬѹǿP1��P2(P1>P2)������CO(g)+2H2(g) ![]() CH3OH(g) ��H��0���״��ٷֺ������¶ȱ仯�����
CH3OH(g) ��H��0���״��ٷֺ������¶ȱ仯�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�����ζ����ɲⶨBa2���ĺ�����ʵ����������С�
��֪��2CrO![]() ��2H��===Cr2O
��2H��===Cr2O![]() ��H2O��Ba2����CrO
��H2O��Ba2����CrO![]() ===BaCrO4��
===BaCrO4��
�������ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ��������ΪV0 mL��
�������ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽�����ͬŨ�ȵ�Na2CrO4��Һ����Ba2����ȫ�������ټ������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ���������ΪV1mL���μ������ҺʱӦ����ʽ�ζ��ܣ���0���̶�λ�ڵζ��ܵ�________(��Ϸ������·���)��BaCl2��Һ��Ũ��Ϊ________mol��L��1����������еμ�����ʱ����������Һ������Ba2��Ũ�Ȳ���ֵ��________(�ƫ��ƫС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�ؾ�����Դ�㷺���۸�����������Ѻá���ȫ�ɿ����ص㣬�ر��ʺ��ڹ̶�ʽ���ģ����Ӧ�õ�����һ����Na2SO4ˮ��ҺΪ���Һ�������ӵ���ܷ�ӦΪ��NaTi2(PO4)3 +2Na2NiFeII (CN)6 ![]() Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(ע������P�Ļ��ϼ�Ϊ+5��Fe���ϱ�II��III�������̬)������˵������ȷ����( )
Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(ע������P�Ļ��ϼ�Ϊ+5��Fe���ϱ�II��III�������̬)������˵������ȷ����( )
A���ŵ�ʱNaTi2(PO4)3������������ԭ��Ӧ
B���ŵ�ʱ���������е�Na������缫������Һ��ͬʱ��Һ�е�Na��Ƕ�뵽����������
C����������������ӦʽΪ��2NaNiFeIII(CN)6��2Na����2e����2Na2NiFeII (CN)6
D���õ���ڽϳ�ʱ���ʹ�ù����е������Һ��Na+��Ũ�Ȼ������ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A.�����ʵ������������������ֱ���ȫȼ�գ����߷ų�������
B.��C(ʯī��s)=C(���ʯ��s) ��H=+1.9kJ/mol��֪�����ʯ��ʯī�ȶ�
C.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l) ��H=��285.8kJ/mol
D.��ϡ��Һ�У�H+(aq)+OH��(aq)=H2O(l) ��H=��57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molKOH����Һ��ϣ��ų�����������57.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2C+O2=2CO�������仯��ͼ��ʾ������˵����ȷ���ǣ� ��
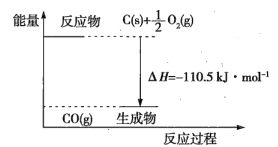
A.12gC(s)��һ����O2(g)��Ӧ����14gCO(g)�ų�������Ϊ110.5kJ
B.2molC(s)������O2(g)��Ӧ����CO2(g)�ų�����������221kJ
C.�÷�Ӧ���Ȼ�ѧ����ʽ��2C(s)+O2(g)=2CO(g) ��H=-221kJ
D.�÷�Ӧ�ķ�Ӧ�ȵ������ɵ�CO(g)�������е�������μӷ�Ӧ��O2(g)�������е������IJ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100��ʱ����0.5molN2O4����ͨ�����Ϊ5L(����)������ܱ������У��������ֺ���ɫ����Ӧ���е�2sʱ��NO2��Ũ��Ϊ0.02mol��L-1����60sʱ����ϵ�Ѵﵽƽ�⣬��ʱ������ѹǿΪ��Ӧǰ��1.6��������˵������ȷ����
A.ƽ��ʱ����ϵ�ں�NO2Ϊ0.04mol��L-1
B.ƽ��ʱ��N2O4��ת����Ϊ60%
C.ǰ2s��N2O4��ƽ����Ӧ����Ϊ0.005mol��L��1��s��1
D.��2sʱ����ϵ��ѹǿΪ��Ӧǰ��1.1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com