
(6分)常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量 ② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的
积是多少毫升?。
(6分)①0.100mol;②1.51mol/L;③30.2mL
【解析】
试题分析:①12.5g CuSO4·5H2O的物质的量是12.5g/250g/mol=0.05mol,溶于水后硫酸铜完全电离,CuSO4·5H2O=Cu2++SO42-+5H2O,所以该溶液中阴阳离子的总物质的量是0.05mol+0.05mol=0.100mol;
②该溶液的总质量是27.5g+12.5g=40.0g,该溶液密度为1.21g /cm3,所以该溶液的体积是V=40.0g/1.21g /cm3=0.033L,则该溶液的物质的量浓度C=n/V=0.05mol/0.033L=1.51mol/L;
③20.0 ml该溶液中硫酸铜的物质的量是0.020L×1.51mol/L=0.0302mol,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的积是0.0302mol/1.00mol/L=0.0302L=30.2mL。
考点:考查溶液中溶质的物质的量、物质的量浓度、溶液的体积的计算


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:2014-2015学年山东安丘市期中考试高二化学模拟(A)卷(解析版) 题型:计算题
(6分)为测定某氧化物(化学式为MO)中M是何种金属,做以下实验:称取该氧化物8.0g溶于适量的稀硫酸中,再配制成250.0mL溶液。取该溶液50.0mL用惰性电极进行电解,当刚好电解完全时,电极析出M 1.28g 。通过计算回答以下问题:
(1)M是什么金属?
(2)最初配制的溶液中,该金属离子物质的量浓度是多少?
(3)若50mL此电解液在电解后体积变为40mL,此时溶液的c(H+)是多少?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东临沂商城实验学校高一10月学情调研考试化学卷(解析版) 题型:选择题
不用其它试剂鉴别①KNO3 ②Ba(OH)2 ③MgSO4 ④CuSO4四种溶液,正确的鉴别顺序是( )
A.①④③② B.④①③② C.④②③① D.①③④②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江淮十校高三8月联考化学试卷(解析版) 题型:选择题
某化学科研小组研究合成氨:N2(g)+3H2(g)  2NH3(g);△H<0,在其他条件不变时,改变某一条件时对化学平衡的影响,得到如下图像,以下对应选项中正确的是( )
2NH3(g);△H<0,在其他条件不变时,改变某一条件时对化学平衡的影响,得到如下图像,以下对应选项中正确的是( )
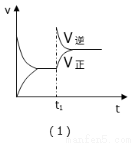

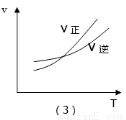
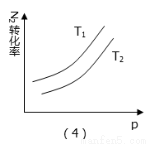
A.(1)对应的是:在t1时恒压条件下,通入NH3,
B.(2)对应的是:氨气在恒容不同温度下的百分含量
C.(3)对应的是:在恒容条件下,反应速率与温度的关系
D.(4)对应的是:N2转化率与温度(T1>T2)、压强的关系
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江淮十校高三8月联考化学试卷(解析版) 题型:选择题
下列离子方程式中,表达正确的是( )
A.向Mg(HCO3)2溶液中,加入过量的澄清石灰水
Mg2+ + 2 HCO3- + Ca2+ + 2OH- = CaCO3↓+ MgCO3↓+ 2H2O
将足量的CO2通入饱和碳酸钠溶液中 CO2 +CO32- + H2O =2HCO3-
C.明矾净水原理 Al3+ + 3H2O  Al(OH)3 +3H+
Al(OH)3 +3H+
D.硫酸亚铁溶液和稀硫酸、过氧化氢混合 Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
某气体的质量是9.5g,体积是5.6升(标准状况下),该气体的摩尔质量是
A.38 B.38g·mol-1 C.19 D.19g·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
容量瓶上需标有以下六项中的
①温度②浓度③容量④压强⑤刻度线⑥酸式或碱式
A.①③⑤ B.③⑤⑥ C.①②④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高二上学期期中考试化学试卷(解析版) 题型:填空题
(11分)(1)某恒温恒容容条件下的可逆反应: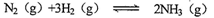 △H<O,起始充入amol N2 、bmol H2,达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 moL,回答下列问题:
△H<O,起始充入amol N2 、bmol H2,达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 moL,回答下列问题:
①a=___________,b=___________。
②平衡后,再充入5 mol NH3,化学平衡将向__________移动(填“左”或“右”或“不移动”),再达新平衡时N2的百分含量_______(填“>”、“<”、“=”)原平衡时N2的百分含量;
③平衡后若升高温度,则平衡向________(填“向左”或“向右”)方向移动;若增加压强,则平衡向________(填“向左”或“向右”)方向移动。
(2)某恒温恒压条件下的可逆反应: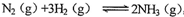 ,起始充入1 mol N2、
,起始充入1 mol N2、
3 molH2 、16 mol NH3,容器的容积为VL。达到平衡后,N2、H2、NH3的物质的量分别为amol、b mol、cmol,此时容器的容积为.1VL,回答下列问题:
①起始时反应速率v(正)____(填“>”、“<”、“=”)v(逆)。
②平衡时a=________,b=_______。
③若平衡后再充入3.6 mol NH3,重新建立平衡时容器的容积为_____________L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.除去镁粉中少量的铝粉,加足量氢氧化钠溶液反应后,过滤
B.做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸
C.金属钠可以保存在煤油里
D.可用过滤的方法除去氢氧化铁胶体中的氯化铁溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com