
| 10x-14 |
| 10-y |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
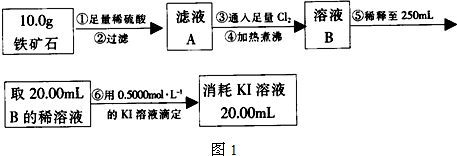

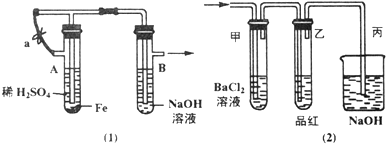
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 结论:该气体具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120℃以上发生分解.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120℃以上发生分解.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
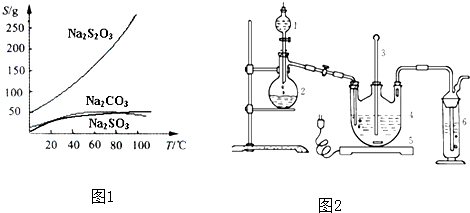
| ||
| 活性炭脱色 |
| 并保温 |
| 操作① |
| 蒸发浓缩 |
| 冷却晶体 |
| 操作② |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x值为2 |
| B、混合气体的密度增大 |
| C、平衡时N的浓度为0.6 mol/L |
| D、N的转化率为80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com