
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表中第____族,其基态原子中未成对电子的个数为______。
(2)[Fe(H2NCONH2)6](NO3)2的名称是三硝酸六尿家合铁(Ⅲ),是一种重要的配合物。该化合物中Fe2+的核外电子排布式为_____,尿素分子中C、N原子的杂化方式分别是____、____,其分子中σ键与π键的数目之比为____,所含非金属元素的电负性由大到小的顺序是____.
(3)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需要知道的数据是________。
(4)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀.则第二种配合物的配体为____。
(5)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图所示,则该物质的化学式为______,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为___pm (阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。

【答案】 Ⅷ 3 [Ar]3d5(或1s22s22p63s23p63d5) sp2 sp3 7∶1 O、N、C、H 离子半径大小 SO42-、NH3 FeC ![]()
【解析】(1)钴的原子序数是27,位于元素周期表中第Ⅷ族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2,未成对电子的个数为3。(2)铁的原子序数是26,Fe2+的核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5);尿素的结构简式为HN2-CO-NH2,碳原子存在双键,氮原子全部是单键,且存在孤对电子,所以分子中C、N原子的杂化方式分别是sp2、sp3。单键都是σ键,双键中含有1个σ键和1个π键,则其分子中σ键与π键的数目之比为7:1。非金属性越强电负性越大,则所含非金属元素的电负性由大到小的顺序是O、N、C、H;(3)晶格能与离子半径和离子所带电荷数有关系,因此比较FeO与NaCl的晶格能大小,还需要知道的数据是离子半径大小。(4)在第一种配合物溶液中加硝酸银溶液产生白色沉淀,白色沉淀是硫酸银,说明硫酸根不是配体。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,沉淀是溴化银,说明溴离子不是配体,则第二种配合物的配体为SO42-、NH3。(5)根据晶胞结构可知铁原子个数是8×1/8+6×1/2=4,碳原子个数12×1/4+1=4,因此该物质的化学式为FeC;晶胞中最近的两个碳原子的距离为面对角线的一半,晶胞的边长=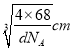 ,面对角线是
,面对角线是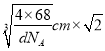 ,所以晶胞中最近的两个碳原子的距离为
,所以晶胞中最近的两个碳原子的距离为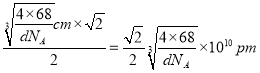 。
。


科目:高中化学 来源: 题型:
【题目】下列物质:①H2O ②石墨 ③NH4NO3 ④液态氯化氢⑤冰醋酸 ⑥蔗糖属于强电解质的是;属于弱电解质的是;属于非电解质的是(用编号填写).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+ O2(g)![]() 2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
A. 达到反应限度时,生成 SO3 为2 mol
B. 达到反应限度时,反应放出 197 kJ 的热量
C. 达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D. 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质溶液中加入Na2SO4可使其变性
B. 蔗糖水解生成互为闻分异构体的葡萄糖和果糖
C. 顺—2一丁烯和反—2—丁烯的加氢产物不同
D. 石油的分馏和煤的于馏均属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M被广泛用于医药、香料的合成,其一种合成路线如下(反应试剂与反应条件已省略):
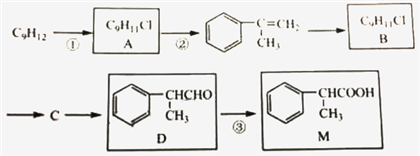
已知A与B互为同分异构体。完成下列填空:
(1)写出M中官能团的电子式:______。1mol D最多能与______mol ![]() 发生加成反应。
发生加成反应。
(2)写出B→C反应的化学方程式:____________。
(3)写出检验D已完全转化为M的方法。____________。
(4)写出核磁共振氢谱有4个峰且峰面积之比为6:2:1:1的M的所有芳香族化合物的结构简式____________。
(5)有人认为仅用反应①就能得到B,但事实证明产物中B的含量远远小于A,由此可以得到的结论是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某pH=1的溶液中,下列各组离子能大量共存的是( )
A. Fe2+、K+、Cl-、NO3- B. Ag+、Na+、NO3-、Cl-
C. Zn2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进入人体的O2有2%转化为氧化性极强的“活性氧”,它能加速人的衰老,被称为“生命杀手”,服用含硒(Se)元素的化合物亚硒酸钠(Na2SeO3)能消除人体内的活性氧。有关此过程中Na2SeO3的说法正确的是
A.作还原剂 B.亚硒酸钠中硒的化合价为+6价
C.既作还原剂又作氧化剂 D.作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列项目判断,结论正确的是
选项 | 项目 | 结论 |
A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJmol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJmol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com