
【题目】T ℃时,向2 L的密闭容器中充入A和B发生反应:aA(g)+bB(g) ![]() cC (g) ΔH<0,容器中A、B、C的物质的量随时间的变化如图所示(t1 min前保持容器的温度和体积不变,t1 时改变反应的某一条件,t1~t2 min间的图像空缺)。下列说法正确的是
cC (g) ΔH<0,容器中A、B、C的物质的量随时间的变化如图所示(t1 min前保持容器的温度和体积不变,t1 时改变反应的某一条件,t1~t2 min间的图像空缺)。下列说法正确的是

A.0~4 min时的平均反应速率v(A)=0.25 mol·L-1·min-1
B.该反应方程式中a、b、c分别为:3、2、2
C.t1 时改变的条件可能是降低温度
D.T ℃时,向2 L的恒容密闭容器中充入2 mol A和2.5 mol B,达平衡时A的转化率大于50%
【答案】AD
【解析】
A. 根据v=![]() 进行计算;
进行计算;
B. 变化量之比等于计量数之比;
C. 根据曲线可知,t1 后物质A、B的物质的量增多,物质C的物质的量减少,说明平衡逆向移动;
D. 向2 L的恒容密闭容器中充入2 mol A和2.5 mol B,相当于增大压强,平衡正向移动。
A. 物质A的起始浓度为![]() =1.5mol/L,达到平衡时A的浓度为
=1.5mol/L,达到平衡时A的浓度为![]() =0.5mol/L,速率v(A)=
=0.5mol/L,速率v(A)=![]() =
=![]() =0.25 mol/(L·min),A项正确;
=0.25 mol/(L·min),A项正确;
B. 物质A的物质的量的变化量为2mol,物质B的物质的量的变化量为1mol,物质C的物质的量的变化量为2mol,因此该反应方程式中a、b、c分别为:2、1、2,B项错误;
C. 根据曲线可知,平衡逆向移动,降低温度,平衡正向移动,因此t1 时改变的条件不可能是降低温度,C项错误;
D. T ℃时,向2 L的密闭容器中充入3molA和2molB时,A的转化率为67%,保持温度不变,向2 L的恒容密闭容器中充入2 mol A和2.5 mol B,相当于增大压强,平衡正向移动,A的转化率增大,因此达平衡时A的转化率大于50%,D项正确;
答案选AD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.1mol NaHSO4熔融态时含有2NA个离子
C.含32g硫原子的CS2分子中含有的σ键数目为2NA
D.常温常压下,10 g D2O含有的质子数、电子数、中子数均为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中,正确的是
A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多
B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1
C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1
D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1B.649 kJ· mol-1C.945.6 kJ· mol-1D.896 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验原理或操作中,正确的是![]()
A.用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高
B.仰视量筒刻度量取一定量浓硫酸所配制的![]()
![]()
![]() 溶液的浓度结果偏低
溶液的浓度结果偏低
C.焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色
D.要将溶解在![]() 中的碘分离出来,应用蒸馏法,因为碘易升华,先分离出来
中的碘分离出来,应用蒸馏法,因为碘易升华,先分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
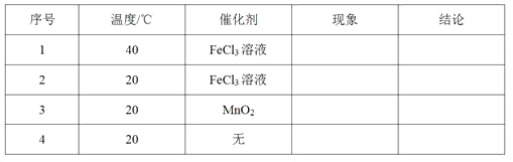
①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
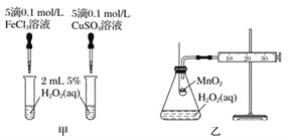
①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com