
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作____。
(2)某学习小组设计用如下图装置验证二氧化硫的化学性质。

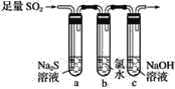
(3)能说明SO2具有氧化性的实验现象为_________________。
(4)为验证SO2的还原性,充分反应后,取试管b中溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色退去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为__________________。
【答案】打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加 a试管中有淡黄色沉淀生成 III SO2+Cl2+2H2O===4H++SO42-+2Cl-
【解析】
(1)要让分液漏斗内的液体流出,漏斗内的压强不能小于烧瓶内的压强,所以应打开分液漏斗上口的塞子,并旋开分液漏斗的旋塞。
(3)证明二氧化硫具有氧化性,可以使另一物质中某元素的价态升高,根据题中提供的物质,只能选择最低价态的硫化钠。
(4)方案Ⅰ:向第一份溶液加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,可能是SO42-的作用;
方案Ⅱ:向第二份溶液加入品红溶液,红色退去,可能是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的。
(1)分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加。答案:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
(3)二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S。答案为:a试管中有淡黄色沉淀生成;
(4)方案Ⅰ:向第一份溶液加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,不能证明二氧化硫具有还原性,此方案不合题意;
方案Ⅱ:向第二份溶液加入品红溶液,红色退去,可能是氯水中含有的漂白性物质次氯酸起的作用,此方案不合题意;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的,即SO2+Cl2+2H2O==4H++SO![]() +2Cl-,S元素的化合价升高,体现二氧化硫的还原性,此实验设计合理,符合题意。答案为:III;SO2+Cl2+2H2O==4H++SO42-+2Cl-。
+2Cl-,S元素的化合价升高,体现二氧化硫的还原性,此实验设计合理,符合题意。答案为:III;SO2+Cl2+2H2O==4H++SO42-+2Cl-。


科目:高中化学 来源: 题型:
【题目】(1)指出如图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
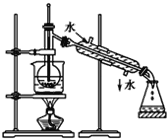
①___;②___。
(2)图是某学生的过滤操作示意图,其操作不规范的是___。
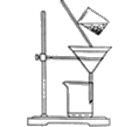
a.漏斗下口尖端未紧靠烧杯壁 b.玻璃棒有引流作用
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘低于漏斗口边缘
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水蒸汽的物质的量分数为0.02。则H2S的平衡转化率为____%,反应平衡常数K=____(保留小数点后两位)。
COS(g) +H2O(g)。在610 K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水蒸汽的物质的量分数为0.02。则H2S的平衡转化率为____%,反应平衡常数K=____(保留小数点后两位)。
Ⅱ、某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下滴定管液面读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是____(填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:____(填编号)。
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.滴定终点俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(l)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢。
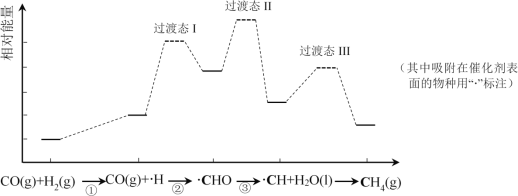
下列说法不正确的是( )
A.步骤①只有非极性键断裂
B.步骤②速率最慢的原因可能是其活化能最高
C.步骤③需要吸收热量
D.使用该催化剂不能有效提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是
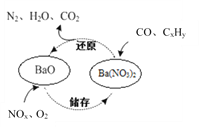
A. 在转化过程中,氮元素均被还原
B. 依据图示判断催化剂不参与储存和还原过程
C. 还原过程中生成0.1mol N2,转移电子数为0.5 mol
D. 三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组同学研究 Cu与H2SO4 溶液反应,小伟同学实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ | 取螺旋状铜丝在酒精灯上烧至红热,迅速伸入装有 10 mL 3 mol/L H2SO4溶液的试管中 | 产生大量白雾;溶液颜色变为浅蓝色;试管中出现红色浑浊 |
Ⅱ | 步骤一:取螺旋状铜丝在酒精灯上烧至红热, 迅速伸入装有10 mL蒸馏水的试管中; 步骤二:冷却后加入5 mL 3 mol/L H2SO4 | 步骤一:产生少量白雾;试管中出现黑色浑浊,略带红色 步骤二:浑浊全部为红色;溶液略显蓝色 |
(1)实验一:探究白雾的成分
①波波同学收集实验Ⅰ中白雾,加入品红溶液,溶液褪色,得出结论:白雾成分包含 SO2。可能是因为局部温度过高产生,写出有关化学方程式 ________。
②艳艳同学认为不妥,补充实验Ⅲ:
实验编号 | 实验操作 | 实验现象 |
Ⅲ | 步骤一:取品红溶液,加 3 mol/L H2SO4溶液,加热; 步骤二:收集实验Ⅰ中白雾,加入品红溶液,加热 | 步骤一:溶液褪色,加热无颜色变化; 步骤二:溶液褪色,加热无颜色变化 |
根据实验Ⅲ,可推断白雾成分是______,而并非SO2。
(2)实验二:探究红色固体的成分。经过分析,实验Ⅰ和实验Ⅱ中的红色浑浊成分相同。
(资料)Cu2O能溶在浓氨水中形成无色Cu(NH3)2+,很容易被氧气氧化为蓝色Cu(NH3)22+;Cu2O能与一定浓度的酸溶液发生反应:Cu2O+2H+=Cu2++Cu+H2O。
①写出Cu2O溶在浓氨水中的离子方程式 _______。
②对于红色浑浊的成分,谷哥设计实验并实施,证实了红色固体中只有Cu2O。他的实验是:将实验Ⅰ试管中固体过滤洗涤,得红色固体,__________。
③结合实验Ⅰ和Ⅱ,吉吉同学确定铜丝烧至红热时生成了______。
(3)实验三:探究红色固体不溶的原因。经过检验,实验Ⅰ和实验Ⅱ反应后的溶液均显酸性,对于体系中有Cu2O固体的原因:
龙校假设:在实验条件下,随着溶液酸性降低,Cu2O与酸无法反应。
乔博假设:在实验条件下,随着溶液酸性降低,Cu2O与酸反应速率变小。
邹邹同学继续实验:
实验编号 | 实验操作 | 实验现象 |
Ⅳ | 取Cu2O固体少量,加入到装有 10 mL3 mol/L H2SO4 溶液的试管中 | 溶液迅速变为蓝色;试管中出现少量亮红色固体 |
Ⅴ | 取Cu2O固体少量,加入到装有 10 mL 3 mol/L H2SO4 和少量CuSO4 (浅蓝色)的试管中 | 现象同Ⅳ |
Ⅵ | 重复实验Ⅰ,振荡试管,分为两等份。第一份立刻加入浓硫酸至 c(H2SO4)=3 mol/L;第二份静置 4 h之后,过滤,向固体中加入浓硫酸至 c(H2SO4)=3 mol/L | 第一份加酸后红色固体明显减少,溶液蓝色加深;第二份静置时,固体减少,溶液缓慢变为蓝色,固体加酸后无明显现象。 |
①实验Ⅴ的目的是 ______。
②通过以上实验,臧臧同学得出的结论是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池可用于有机废水的处理,如图是利用微生物处理含尿素[CO(NH2)2]废水的装置。下列说法中正确的是

A. 该装置外电路中箭头的方向代表电流的方向
B. M电极反应式为CO(NH2)2-6e-+H2O=CO2↑+6H++N2↑
C. 当有1mlH+通过质子交换膜时,N极消耗5.6LO2
D. 该处理工艺会导致废水酸性增强,仍旧不能直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
C(石墨)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为____;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为_;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:_____;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是_____(填序号)
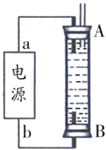
A.电源中的a一定为正极,b一定为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为_____(填“吸”或“放”)热反应;
②实验2中,平衡常数K=_____;
③实验3跟实验2相比,改变的条件可能是_____(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com