
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):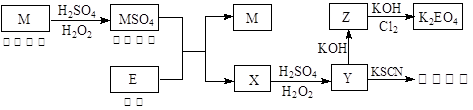
(1)写出M溶于稀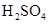 和
和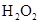 混合液的离子方程式: 。
混合液的离子方程式: 。
(2)检验X中阳离子的方法和现象是 。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有 、 、 (填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。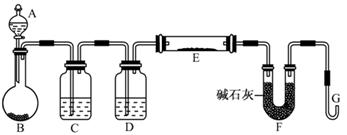
①仪器B中应装入 ,装置D的作用 ;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
在这两步之间还应进行的操作是 ;
(1) (2分)
(2分)
(2)取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色。(2分)
(3)4Fe2+ + O2 +4H+=4Fe3+ +2H2O (2分) 2Fe3+ + 2I-= 2Fe2+ + I2 (2分)
(4)烧杯、漏斗、玻璃棒(2分,多答、少答、错答均不得分)
(5)①锌粒(Zn)(1分) 吸收水蒸气,干燥H2(1分)
②从A瓶中逐滴加入液体(1分) 检验H2的纯度(1分)
解析试题分析:(1)M为红色,而MSO4溶液为蓝色,可推知M为Cu,进而可得Cu在酸性条件下被H2O2氧化的离子方程式。
(2)X被H2O2氧化后得Y,加入KSCN后得红色溶液,说明X中阳离子为Fe2+,用KSCN和新制氯水检验。
(3)在空气中放置发生的反应为Fe2+被O2氧化为Fe3+,酸化并加入KI和淀粉溶液,Fe3+把I?氧化为I2。
(4)过滤时需要用到烧杯、漏斗、玻璃棒。
(5)制取H2需要Zn,B中应加入锌粒,需要用干燥的H2还原CuO,所以装置D的作用为:吸收水蒸气,干燥H2,先成H2,把空气赶出装置后再加热,易燃气体再加热前都要检验纯度。
考点: 本题考查物质的推断和方程式的书写、基本仪器和基本操作。


科目:高中化学 来源: 题型:实验题
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下: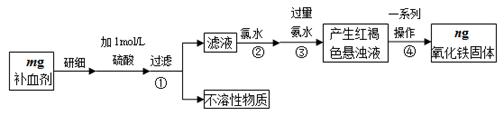
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要 。
(2)步骤②加入过量氯水后发生反应的离子方程式为 。
(3)步骤④中一系列操作步骤为 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加 _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有 性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是 。
| A.KSCN溶液 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。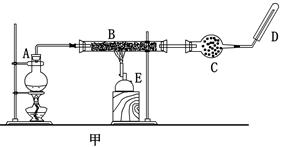
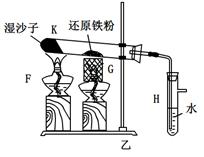
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒
精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性: 。
(2)乙装置中湿沙子的作用是: 。
(3)B处发生反应的化学方程式: 。
(4)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为 (列出计算式即可,不必化简)。
(5)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是: _。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 | 思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般 物质有还原性, 物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是 (用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 | …… |
| …… | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(1)对固体产物中Fe化合价的猜想:
猜想一:只显+2价 猜想二:只显+3价;猜想三: 。
(2)为证明猜想二通过完成下表加以验证。供选试剂有: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L H2SO4溶液、3%H2O2溶液、0.1 mol/LKSCN溶液、蒸馏水。(仪器自添)
| 实验操作 | 现象 | 目的或结论 |
| 步骤1:取适量上述热分解后的固体于试管中,加入0.1 mol/L H2SO4溶液使其充分溶解,将上层清液分加到A、B两支试管中 | | 溶解固体产物 |
| 步骤2: | | 溶液中含有Fe3+ |
| 步骤3: | | 溶液中不含 Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4 ],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下: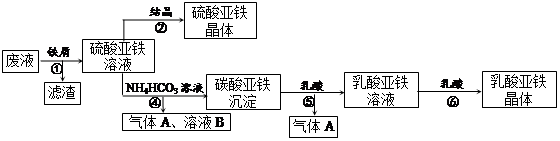
请回答:
(1)步骤①中分离操作的名称是_______;步骤⑥必须控制一定的真空度,原因是______________
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2?xH2O)的化学方程式为_________
_ ;步骤④的离子方程式为____________________________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因______________________________。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:
_____ Fe2+ + _____ MnO4- + _____ H+ = _____Fe3+ +_____ Mn2+ +_____
取步骤②所得晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1 KMnO4溶液20.00mL,则所得晶体中FeSO4? 7H2O的质量分数为(以含a的式子表示) _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.同体产物为MgO。
II.假设为______________。
III.假设为:______________。
请回答下列问题:
资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
(1)如图连接好仪器,装药品前如何检验装置的气密性_______。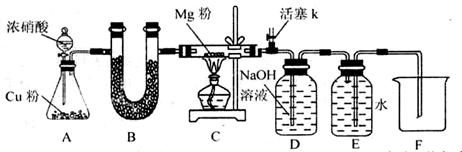
(2)装置B中盛装的干燥剂可以是(填序号)_______。
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的都是______________。
(4)E中收集到的气体对氢气的相对密度是14,该气体是_______。
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设_______成立。C中发生的化学反应方程式为______________
(6)本实验中存在明显缺陷,改进措施是___________
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向1.00L0.3mol·L-NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,有关该溶液
的说法正确的是
| A.溶质为Na2CO3 |
B.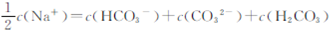 |
C.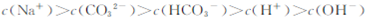 |
D.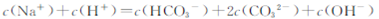 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
绿色化学要求利用化学反应原理从源头上消除污染。以铜为原料制备硫酸铜,下列四种原理设计,其中最能体现“绿色化学”要求的是
A.Cu +2H2SO4(浓)  CuSO4 +SO2↑+2H2O CuSO4 +SO2↑+2H2O |
B.Cu +Cl2 CuCl2,CuCl2+ H2SO4(浓) CuCl2,CuCl2+ H2SO4(浓)  CuSO4 +2HCl↑ CuSO4 +2HCl↑ |
C.Cu + H2SO4 +H2O2 CuSO4 +2H2O CuSO4 +2H2O |
D.3Cu +8HNO3=3Cu(NO3)2 +2NO↑+4H2O,Cu(NO3)2+H2SO4(浓)  CuSO4 +2HNO3↑ CuSO4 +2HNO3↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com