
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、上述气体检测时,敏感电极均作电池正极 |
| B、检测Cl2气体时,敏感电极的电极反应为:Cl2+2e-═2Cl- |
| C、检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- |
| D、检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |


科目:高中化学 来源: 题型:
| w(X) | w(Y) | 101.3kPa、t℃时密度(g/L) | 沸点(℃) | |
| A | 0.111 | 0.889 | 1000(4℃) | 100 |
| B | 0.200 | 0 | 1.34(0℃) | -88.6 |
| C | 0.125 | 0.500 | - | 64. 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
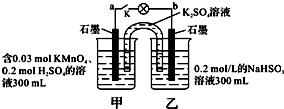
| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电极一定要由两种不同的金属组成 |
| B、电子流出的一极是正极 |
| C、两极均发生氧化还原反应 |
| D、由化学能转化为电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、锌作正极 |
| B、溶液中SO42-向铜电极方向移动 |
| C、电子由锌片通过导线流向铜 |
| D、负极发生的反应是:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1电池放电过程中,Na+从负极区向正极区迁移 |
| B、图1电池负极区的电极反应为:BH4--8e-+8OH-═BO2-+6H2O |
| C、图2中若电解过程中转移了a mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为6.2a g |
| D、图2阴极反应式为:2NO3-+6H2O+10e-═N2↑+12OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com