

| ||
| ||
| ||
| 0.2mol |
| 2 |
| 0.2mol |
| 12 |


科目:高中化学 来源: 题型:
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、上述气体检测时,敏感电极均作电池正极 |
| B、检测Cl2气体时,敏感电极的电极反应为:Cl2+2e-═2Cl- |
| C、检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- |
| D、检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )
反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )| A、T1>T2,P1<P2 |
| B、T1>T2,P1>P2 |
| C、T1<T2,P1>P2 |
| D、T1<T2,P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |||
B、乙醇催化氧化:2CH3CH2OH+O2
| |||
C、苯与氢气加成: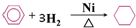 | |||
| D、从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
283 116 |
| A、这种元素一定是金属元素 |
| B、它位于元素周期表中的第六周期 |
| C、这种原子的核外电子数为167 |
| D、这种元素的原子易与氢化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com