
【题目】如图是原子序数为1~19的元素第一电离能的变化曲线(其中部分元素第一电离能已经标出数据)。结合元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列有关问题。
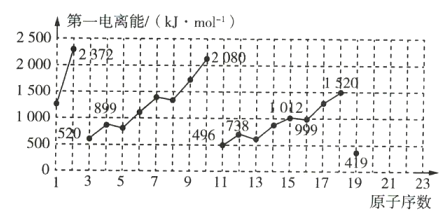
(1)碱金属元素中Li、Na、K的第一电离能分别为 _____________ ![]() 、 _____________
、 _____________ ![]() 、 _____________
、 _____________ ![]() 。
。
(2)同主族中不同元素的第一电离能变化的规律为: _____________ ,碱金属元素这一变化的规律与碱金属的活泼性的关系是 _____________ 。
(3)钙元素的第一电离能的数值范围为 _____________ 。
【答案】520 496 419 随着原子序数的增大,第一电离能逐渐变小 金属越活泼,其第一电离能越小 大于419小于496
【解析】
(1)根据图示判断电离能;
(2)随着原子序数的增加,第一电离能逐渐减小;
(3)根据周期表中Ca和 K的位置关系,同周期元素随原子序数增大,第一电离能呈现增大的趋势,比较出Ca和 K的第一电离能的大小。
(1)Li、Na、K的原子序数分别为3、11、19,图中对应的第一电离能的数值分别为520、496、419;
(2)由碱金属元素第一电离能的变化可知,随着原子序数的增加,第一电离能逐渐减小,而且随着原子序数的增加,同主族元素的金属性逐渐增强;
(3) 同周期随原子序数增大,第一电离能呈增大趋势,Ca的第一电离能应高于K的,Ca比较Na活泼,其第一电离能而小于Na,即Ca的第一电离能:419kJ/mol<E(Ca)<496kJ/mol。


科目:高中化学 来源: 题型:
【题目】NH3、NOx、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(l)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。已知:
![]() ①
①
![]() ②
②
则反应![]() (1)△H=_______
(1)△H=_______
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:
①在一定温度条件下,向2L恒容密闭容器中加入2 mol CH4和2 mol NH3,平衡时NH3体积分数为30%,所用时间为10 min,则该时间段内用CH4的浓度变化表示的反应速率为______ mol·L-l·min-1,该温度下平衡常数K= ___。若保持温度不变,再向容器中加入CH4和H2各1 mol,则此时v正 ___(填“>”“=”或“<”)v逆 。
②其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图1所示。X代表 ___(填字母代号)。
A 温度 B 压强 C 原料中CH4与NH3的体积比
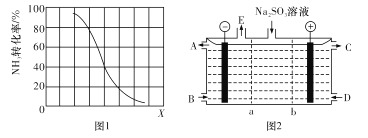
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨。A--E分别代表生产中的原料或产品,b表示____(填“阴”或“阳”)离子交换膜。阳极的电极反应式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铅蓄电池放电时,负极质量减轻,正极增重
B.升高CH3COONa溶液的温度,其水的离子积常数和pH均增大
C.CH3CH=CHCH3分子中的四个碳原子都在一条直线上
D.常温下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,则S(AgBr)>S(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.100 mL 1 mol·L-1 NaClO溶液中ClO-的数目为0.1NA
B.46 g 75%的C2H5OH溶液中所含O原子数目为0.75NA
C.7.6 g过氧乙酸(CH3COOOH)所含过氧键数目为0.1NA
D.标准状况下,22.4 L 氯气与水充分反应转移电子数目NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》报导我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A.c为电源的负极
B.a极的电极反应式为:2C2O52- -4e- =4CO2 ↑+O2↑
C.①②中,捕获CO2时碳元素的化合价均未发生变化
D.转移l mol电子可捕获CO2 11.2 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喹啉(![]() )是治疗新冠肺炎的药物氯喹的基础原料,其合成路线如下:
)是治疗新冠肺炎的药物氯喹的基础原料,其合成路线如下:
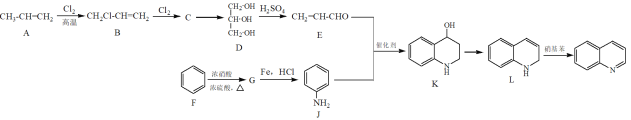
下列有关说法正确的是
A.C→D的反应条件为NaOH水溶液,加热
B.可以用溴水来检验化合物E中的碳碳双键
C.F→G和G→J的反应类型分别为取代反应和还原反应
D.与喹啉互为同分异构体,且含有碳碳双键和氰基(-CN)的芳香族化合物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。

根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是__。
(2)PCl5分解成PCl3和Cl2的热化学方程式是__。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3=_,P和Cl2一步反应生成1molPCl5的ΔH4__ΔH3(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com