
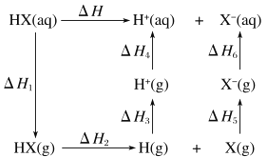
����Ŀ������P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ���̺�������ϵ��ͼ��ʾ(ͼ�е���H��ʾ����1mol���������)��

����ͼ�ش��������⣺
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ��__��
��2��PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽ��__��
��3��P��Cl2��������Ӧ����1molPCl5����H3=_��P��Cl2һ����Ӧ����1molPCl5����H4__��H3(������������С��������������)��
���𰸡�P(s)+Cl2(g)=PCl3(g)��H=-306kJ/mol PCl5 (g)= PCl3 (g)+Cl2(g)��H=+93kJ/mol�� 399kJ/mol ����
��������
���ݸ�˹���ɣ���Ӧ����;���أ�ֻ����ʼ���ʡ����������йأ��Դ˽���⡣
(1)�������������ȥ��Ӧ����������͵�����H�����ͼ���֪��PCl3�ͷ�Ӧ��P��Cl2��������Ϊ306kJ����˸��Ȼ�ѧ����ʽΪ��P(s)+Cl2(g)=PCl3(g)��H=-306kJ/mol���ʴ𰸣�P(s)+Cl2(g)=PCl3(g)��H=-306kJ/mol��
(2)����ͼ���֪PCl5��PCl3��Cl2֮���������Ϊ-93kJ�����PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽΪ��PCl5 (g)= PCl3 (g)+Cl2(g)��H=+93kJ/mol���ʴ𰸣�PCl5 (g)= PCl3 (g)+Cl2(g)��H=+93kJ/mol��
(3)���ݸ�˹���ɣ���H=-306kJ/mol-93kJ/mol=-399kJ/mol���÷�Ӧ����;���أ�ֻ����ʼ���ʡ����������йأ�����P��Cl2һ����Ӧ����1molPCl5����H4������H3���ʴ𰸣�399kJ/mol�����ڡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ͻ����õ�������������Ȼ��ʯ�ɷ֣���ʯ����������B��C��O��Na��P��Cl��Ԫ�أ������ڿ�ѧ�о���ҵ�����о���������;����ش������й����⣺
(1)�ִ���ѧ�У�������___�ϵ���������������Ԫ�ء�
(2)![]() ��
��![]() ��
��![]() ������Ҫ���л���Ӧ�м��塣
������Ҫ���л���Ӧ�м��塣![]() ��̼ԭ�ӵ��ӻ���ʽΪ_______��
��̼ԭ�ӵ��ӻ���ʽΪ_______��![]() �Ŀռ乹��Ϊ_____��
�Ŀռ乹��Ϊ_____��
(3)![]() ��
��![]() ��Ϊ�ȵ����壬������
��Ϊ�ȵ����壬������![]() ___
___![]() ������>������<������
������>������<������
(4)��ҵ����ȡ���ʷ���ͨ�����![]() ��
��![]() �Ļ����Һ��ã���
�Ļ����Һ��ã���![]() ��Ϊ�ȵ�����ķ���Ϊ_____������һ�֣���
��Ϊ�ȵ�����ķ���Ϊ_____������һ�֣���
(5)��±�ᣨ![]() ���ĵ��������ͼ��
���ĵ��������ͼ��![]() ��
��![]() �ĵݱ���ɶ���
�ĵݱ���ɶ���![]() ������
������![]() �ر���ԭ��Ϊ__________����ԭ�ӽṹ����Ӱ��
�ر���ԭ��Ϊ__________����ԭ�ӽṹ����Ӱ��![]() �ݱ������Ϊ_____��
�ݱ������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ԭ������Ϊ1��19��Ԫ�ص�һ�����ܵı仯����(���в���Ԫ�ص�һ�������Ѿ��������)�����Ԫ����Ԫ�����ڱ��е�λ�ã�����ͼ�����ߵı仯�ص㣬���ش������й����⡣
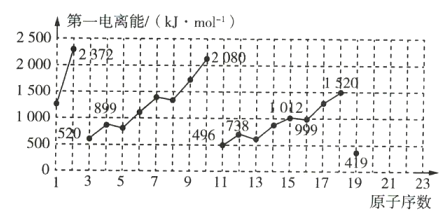
(1)�����Ԫ����Li��Na��K�ĵ�һ�����ֱܷ�Ϊ _____________ ![]() �� _____________
�� _____________ ![]() �� _____________
�� _____________ ![]() ��
��
(2)ͬ�����в�ͬԪ�صĵ�һ�����ܱ仯�Ĺ���Ϊ�� _____________ �������Ԫ����һ�仯�Ĺ����������Ļ����ԵĹ�ϵ�� _____________ ��
(3)��Ԫ�صĵ�һ�����ܵ���ֵ��ΧΪ _____________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1��H2(g)��![]() O2(g)=H2O(g) ��H1=akJ��mol-1
O2(g)=H2O(g) ��H1=akJ��mol-1
��2��2H2(g)��O2(g)=2H2O(g) ��H2=bkJ��mol-1
��3��H2(g)��![]() O2(g)=H2O(l) ��H3=ckJ��mol-1
O2(g)=H2O(l) ��H3=ckJ��mol-1
��4��2H2(g)��O2(g)=2H2O(l) ��H4=dkJ��mol-1�����й�ϵʽ����ȷ���ǣ� ��
A.a<c<0B.2a=b<0C.b>d>0D.2c=d>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з�����Ӧ��xA(g)+yB(g)![]() zC(g)��ƽ��ʱ���A��Ũ��Ϊ0.50mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ�����A��Ũ��0.30mol/L�������й��ж���ȷ���ǣ� ��
zC(g)��ƽ��ʱ���A��Ũ��Ϊ0.50mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ�����A��Ũ��0.30mol/L�������й��ж���ȷ���ǣ� ��
A.x+y<z
B.ƽ��������Ӧ�����ƶ�
C.A��ת���ʽ���
D.C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2(g)��H2(g) ![]() CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
CO(g)��H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
t �� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��_________________________________��
��2���÷�ӦΪ________��Ӧ(��������������������)��
��3��ij�¶��£������ʵ�ƽ��Ũ�ȷ�����ʽ��3c(CO2)��c(H2)��5c(CO)��c(H2O)�����жϴ�ʱ���¶�Ϊ______��
��4����830 ��ʱ���������г���1 mol CO��5 mol H2O����Ӧ�ﵽƽ����仯ѧƽ�ⳣ��K______1.0(������������С��������������)��
��5��830 ��ʱ�������еķ�Ӧ�Ѵﵽƽ�⡣�������������������£����������������ƽ��____�ƶ�(����������Ӧ�����������淴Ӧ��������������)��
��6����1 200 ��ʱ����ijʱ��ƽ����ϵ��CO2��H2��CO��H2O��Ũ�ȷֱ�Ϊ2 mol��L��1��2 mol��L��1��4 mol��L��1��4 mol��L��1�����ʱ������Ӧ��ƽ���ƶ�����Ϊ__________(��������Ӧ���������淴Ӧ�������������ƶ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ָ���ڻ�̬����̬ԭ��ʧȥһ�����ӣ�����+1����̬����������Ҫ����������ͼ�Dz���Ԫ�صĵ�һ������I1��ԭ�������仯������ͼ��
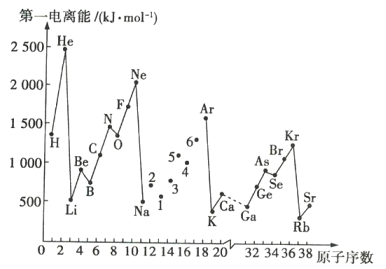
��ش��������⣺
��1������ͼ��ͬ����Ԫ�ص�һ�����ܵı仯���ɣ���Na��Ar֮��1~6��Ԫ���ö�����������������������ͼ��___��
��2������ͼ������֪��ͬ����Ԫ�صĵ�һ�����ܵı仯������___��
��3��ͼ��5��Ԫ����Ԫ�����ڱ��е�λ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ�� W��X��Y��Z��ԭ��������������W �ڴ�����������ͬ���������Ҿ���֧��ȼ�գ�X ��ԭ�Ӱ뾶�����ж���������Ԫ�������ģ��ǽ���Ԫ�� Y ��ԭ �������� Z �������������� 2 ����������������ȷ����
A.Y��Z���⻯���ȶ��� Y> Z
B.Y���ʵ��۵����X ����
C.X��W��Z ���γɾ���ǿ�����Ե� XZW
D.YZ4������ Y �� Z �� ����8 �����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ����Ҫ�Ի����������ȫ�桢ϵͳ�Ŀɳ�����������ɫ��Դ��ʵʩ�ɳ�����չ ����Ҫ;�������������Ҵ�����ȡ��ɫ��Դ�����IJ��ַ�Ӧ������ͼ��ʾ��
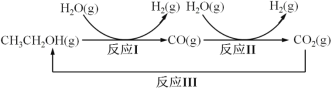
��1����֪��CO(g)+H2O(g) ![]() CO2(g)+H2(g) ��H1= - 41 kJ/mol
CO2(g)+H2(g) ��H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) ��H2=+174.1 kJ/mol
2CO2(g)+6H2(g) ��H2=+174.1 kJ/mol
��д����Ӧ I ���Ȼ�ѧ����ʽ____________��
��2����Ӧ II���ڽ�����[n(CO) : n(H2O)]��ͬʱ�������Ӧ�� CO ƽ��ת���ʼ�ͼ�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ�������Ӧ��������Ӧ��������ͬ����

�پ�������A��E �� G �����Ӧ�ķ�Ӧ�¶���ͬ����ԭ���� KA=KE=KG=____________������ֵ�����ڸ��¶��£�Ҫ��� COƽ��ת���ʣ����˸ı������֮�⣬���ɲ�ȡ�Ĵ�ʩ��____________��
�� �Աȷ��� B��E��F ���㣬�ɵó���Ӧ�Ľ����Ⱥͷ�Ӧ�¶ȵı仯����֮��Ĺ�ϵ��____________��
�� �Ƚ� A��B �����Ӧ�ķ�Ӧ���ʴ�С��VA____________VB������<�� ��=������>��������֪��Ӧ���� v=v ��v ��= k��X��CO��X��H2O����k��X��CO2��X��H2����k ����k ���ֱ�Ϊ��������Ӧ���ʳ�����XΪ���ʵ������������ڴﵽƽ��״̬ΪD��ķ�Ӧ�����У���COת���ʸպôﵽ20%ʱ��![]() =_____________������������1λС������
=_____________������������1λС������
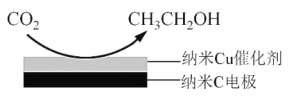
��3����Ӧ III ����̼�����Һ���� CO2 �õ����� KHCO3 ���Һ������� CO2 ���Ʊ��Ҵ���
����֪̼��ĵ��볣�� Ka1=10-a mol��L1��Ka2=10-b mol��L1���������� CO2 ���ñ��� KHCO3 ��Һ�� pH=c�������Һ��lg![]() =________________
=________________
���ڱ��� KHCO3 ���Һ�е�� CO2 ���Ʊ��Ҵ���ԭ����ͼ��ʾ���������ĵ缫��Ӧʽ��__________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com