
【题目】煤炭是重要的化工原料,但属于不可再生能源,高效、清洁地利用煤炭资源至关重要。请回答下列问题:
(1)煤的气化。原理是C(s)+2H2(g)![]() CH4(g) ΔH。
CH4(g) ΔH。
在1L密闭容器中投入1mol碳,并充入2molH2,测得相关数据如图所示。
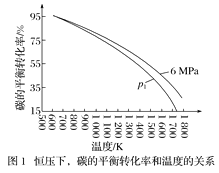

①有关图1、图2的说法正确的有___(填字母)。
a.p1<6MPa b.T1<1000K
c.ΔH<0 d.工业生产中,当温度为T2时,压强越高,经济效益越好
②图2中A点对应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)煤生产水煤气和半水煤气。
①工业上用煤生产作为合成氨原料气的水煤气,要求气体中(CO+H2)与N2的体积之比为3.1~3.2,发生的反应有C(s)+H2O(g)![]() CO(g)+H2(g),C(s)+
CO(g)+H2(g),C(s)+![]() O2(g)
O2(g)![]() CO(g)。从能量角度考虑,通入空气的目的是___。
CO(g)。从能量角度考虑,通入空气的目的是___。
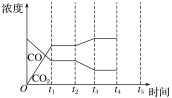
②如图是反应CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
【答案】abc ![]() 前者是吸热反应,通入空气后发生的反应是放热反应,可维持体系的热量平衡 降低温度(或增大水蒸气的量、减少氢气的量)
前者是吸热反应,通入空气后发生的反应是放热反应,可维持体系的热量平衡 降低温度(或增大水蒸气的量、减少氢气的量) 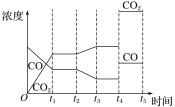
【解析】
(1)a.由C(s)+2H2(g)![]() CH4(g),是气体体积减小的反应;
CH4(g),是气体体积减小的反应;
b.升温碳转化率减小说明正反应为放热反应;
c.升温碳转化率减小说明正反应为放热反应;
d.工业生产中,当温度为T2 时,碳转化率已经较大,增大压强对转化率影响不大;
②A点压强4.5MPa,碳的转化率50%,结合三行计算列式得到平衡状态下气体物质的量,用平衡分压代替平衡浓度计算平衡常数,分压=总压×物质的量分数;
(2)①发生的反应有C(s)+H2O(g)![]() CO(g)+H2(g),C(s)+
CO(g)+H2(g),C(s)+![]() O2(g)
O2(g)![]() CO(g),从能量角度考虑,前者为吸热反应,后者为放热反应,通入空气的目的是维持热量平衡;
CO(g),从能量角度考虑,前者为吸热反应,后者为放热反应,通入空气的目的是维持热量平衡;
②由图可知,t2时刻后二氧化碳浓度增大,一氧化碳浓度减小,改变条件,平衡向正反应方向移动,结合平衡移动原理与反应特点分析解答,CO(g)+H2O(g)![]() H2(g)+CO2(g)反应为气体体积不变的反应,若t4 时刻通过改变容积的方法将压强增大为原来的2 倍,反应速率增大,平衡不移动,据此画出图像。
H2(g)+CO2(g)反应为气体体积不变的反应,若t4 时刻通过改变容积的方法将压强增大为原来的2 倍,反应速率增大,平衡不移动,据此画出图像。
(1)a.由C(s)+2H2(g)![]() CH4(g),是气体体积减小的反应,温度相同时,压强越大,碳的转化率越高,p1<6MPa ,故a正确;
CH4(g),是气体体积减小的反应,温度相同时,压强越大,碳的转化率越高,p1<6MPa ,故a正确;
b.升温碳转化率减小说明正反应为放热反应,T1状态下碳转化率大,说明T1<1000K,故b正确;
c.升温碳转化率减小说明正反应为放热反应,ΔH<0 ,故 c正确;
d.工业生产中,当温度为T2 时,碳转化率已经较大,增大压强对转化率影响不大,压强越高,需要设备材料承受能力越高,不能提高经济效益,故d错误;
故选abc;
②A点压强4.5MPa,碳的转化率50%,结合三行计算列式得到平衡状态下气体物质的量,在1L密闭容器中投入1mol碳,并充入2 mol H2,
C(s)+2H2(g)![]() CH4(g)
CH4(g)
起始量(mol) 1 2 0
变化量(mol)0.5 1 0.5
平衡量(mol)0.5 1 0.5
A 点对应的平衡常数Kp=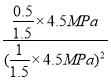 =
=![]() ;
;
(2)①发生的反应有C(s)+H2O(g)![]() CO(g)+H2(g),C(s)+
CO(g)+H2(g),C(s)+![]() O2(g)
O2(g)![]() CO(g),从能量角度考虑,通入空气的目的是:前者是吸热反应,通入空气后发生的是放热反应,可维持体系的热平衡;
CO(g),从能量角度考虑,通入空气的目的是:前者是吸热反应,通入空气后发生的是放热反应,可维持体系的热平衡;
②由图可知,t2时刻后二氧化碳浓度增大,一氧化碳浓度减小,改变条件,平衡向正反应方向移动,反应是放热反应,可降低温度使平衡正向进行,或降低氢气的浓度或增大水蒸气的浓度,使平衡向正反应方向移动,CO(g)+H2O(g)![]() H2(g)+CO2(g)反应为气体体积不变的反应,若t4 时刻通过改变容积的方法将压强增大为原来的2 倍,反应速率增大,平衡不移动,瞬时CO、CO2的浓度都变为2倍,则图中t4~t5区间内CO、CO2浓度变化曲线为:
H2(g)+CO2(g)反应为气体体积不变的反应,若t4 时刻通过改变容积的方法将压强增大为原来的2 倍,反应速率增大,平衡不移动,瞬时CO、CO2的浓度都变为2倍,则图中t4~t5区间内CO、CO2浓度变化曲线为: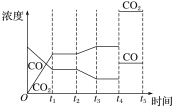 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)![]() H2
H2![]() O的摩尔质量为____________,相同质量的
O的摩尔质量为____________,相同质量的![]() H2
H2![]() O与
O与![]() H2
H2![]() O所含质子数之比为______,中子数之比为__________。
O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol,一定条件下体系中各物质浓度随时间变化的曲线如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ/mol,一定条件下体系中各物质浓度随时间变化的曲线如图所示。下列说法正确的是( )
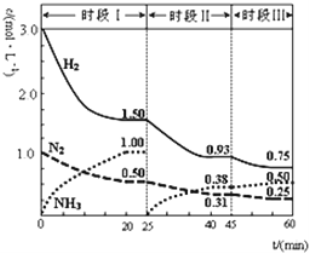
A.前20分钟内反应放出的热量为46.2kJ
B.时段Ⅰ,若仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变
C.第25分钟改变的条件可以是将NH3从反应体系中分离出去
D.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件一定是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)根据下列变化关系:

请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。
(1)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。测得NO2的物质的量分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0kJ·mol1。测得NO2的物质的量分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20 min内,υ(N2O4)=___mol·L1·min1。
②上述反应中,υ正(NO2)=k1·c2(NO2),υ逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为___。改变温度至T1时k1=k2,则T1__373K(填“>”“<”或“=”)。
(2)NH3催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(l) ΔH,向容积为2L的恒容密闭容器中,充入NO2和NH3的混合气体0.14mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
7N2(g)+12H2O(l) ΔH,向容积为2L的恒容密闭容器中,充入NO2和NH3的混合气体0.14mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
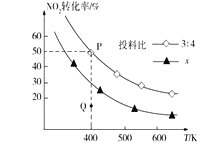
①ΔH___0(填“>”“<”或“=”)。
②x___3∶4(填“>”“<”或“=”)。
③400K时,反应的平衡常数为___(填计算式即可)。
④投料比为3∶4时,Q点υ逆(NH3)___(填“>”“<”或“=”)P点υ逆(NH3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:___;
(2)该反应的正反应为__反应(“吸热”或“放热”);
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是__(填代号)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
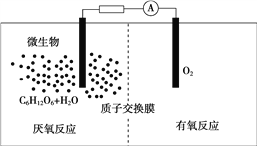
A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1mol/LH2SO4溶液的叙述错误的是
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com