
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
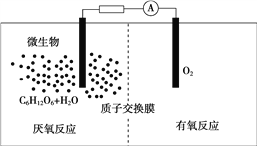
A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
【答案】B
【解析】A.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,选项A正确;B .根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O﹣24e﹣=6CO2+24H+,正极的电极反应式为O2+4e﹣+4H+═2H2O,因此CO2在负极产生,选项B错误;C.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,选项C正确;D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,选项D正确;答案选B。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭是重要的化工原料,但属于不可再生能源,高效、清洁地利用煤炭资源至关重要。请回答下列问题:
(1)煤的气化。原理是C(s)+2H2(g)![]() CH4(g) ΔH。
CH4(g) ΔH。
在1L密闭容器中投入1mol碳,并充入2molH2,测得相关数据如图所示。
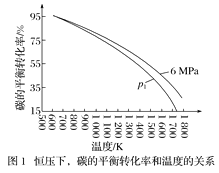

①有关图1、图2的说法正确的有___(填字母)。
a.p1<6MPa b.T1<1000K
c.ΔH<0 d.工业生产中,当温度为T2时,压强越高,经济效益越好
②图2中A点对应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)煤生产水煤气和半水煤气。
①工业上用煤生产作为合成氨原料气的水煤气,要求气体中(CO+H2)与N2的体积之比为3.1~3.2,发生的反应有C(s)+H2O(g)![]() CO(g)+H2(g),C(s)+
CO(g)+H2(g),C(s)+![]() O2(g)
O2(g)![]() CO(g)。从能量角度考虑,通入空气的目的是___。
CO(g)。从能量角度考虑,通入空气的目的是___。
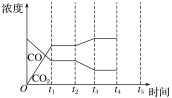
②如图是反应CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4通常为晶体,易溶于水,试回答下列问题:
(1)NaHSO4在物质分类中属于________,
A 钠盐 B 含氧酸 C 酸式盐 D 氧化物
写出NaHSO4在熔融状态下的电离方程式_____________。NaHSO4水溶液能否与Mg反应?________(填“能”或“否”),如果能,写出离子方程式:_________(如果不能此问不作答)
(2)某同学探究溶液的导电性与离子浓度的关系,做了实验,滴定管是用于滴加溶液的仪器。

①若烧杯中所盛液体是NaHSO4溶液,滴定管内是Ba(OH)2溶液,随着Ba(OH)2溶液的滴加,灯泡逐渐变暗,当滴加至溶液呈中性时的离子方程式:_______,继续滴加,发生反应的离子方程式为:__________。
②下列哪种组合可使滴加过程中灯泡先变亮后变暗_______
A 向醋酸中滴加相同浓度的氨水
B 石灰乳中滴加稀盐酸
C 向盐酸中滴加相同浓度的氢氧化钠溶液
D 向醋酸钠溶液中滴加相同浓度的盐酸至过量
③若将NaHSO4换成NH4HSO4溶液,加入足量的Ba(OH)2溶液,发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氢氧燃料电池的示意图,按图中提示,下列叙述不正确的是( )

A. a电极是负极,b电极是正极
B. a电极的电极反应式为H2-2e-===2H+
C. b电极的电极反应式为4OH--4e-===2H2O+O2↑
D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100molL-1的NH4SCN溶液滴定25.00mL0.100molL-1AgNO3溶液,以NH4Fe(SO4)212H2O为指示剂,测得溶液中pSCN=lgc(SCN-)、pAg=lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。已知:Ag++SCN-AgSCN↓,Ksp(Ag2SO4)=1.4×10-5。下列说法错误的是( )

A.滴定至终点时溶液颜色变为红色,且振荡后不褪色
B.该温度下AgSCN的溶度积常数Ksp=1.0×10-12
C.为防止指示剂失效,溶液应维持酸性
D.当加入15.00mLNH4SCN溶液时,溶液中c(SO42-)=0.14molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
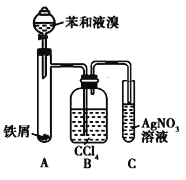
(1)装置C中观察到的现象是_____,证明_____。
(2)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_____,原因是_____;
(3)如果没有装置B,将装置A、C直接相连,则该套实验装置 _____(填“合理”或 “不合理”),原因是_____。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_____(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为短周期主族元素,且原子序数依次递增。Q的低价氧化物与R单质分子的电子总数相等,X与Q同族,Y和Z的离子与Ar原子的电子结构相同。
(1)Q的最高价氧化物中Q的杂化类型为___,分子中含有___个σ键,___个π键。
(2)X的氢化物分子的立体构型是___,属于__分子(填“极性”或“非极性”);它与R形成的化合物可作为一种重要的陶瓷材料,其化学式是___。
(3)Q分别与Y、Z形成的共价化合物的化学式是___和___;Q与Y形成的分子的电子式是__,属于___分子(填“极性”或“非极性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com