
【题目】NaHSO4通常为晶体,易溶于水,试回答下列问题:
(1)NaHSO4在物质分类中属于________,
A 钠盐 B 含氧酸 C 酸式盐 D 氧化物
写出NaHSO4在熔融状态下的电离方程式_____________。NaHSO4水溶液能否与Mg反应?________(填“能”或“否”),如果能,写出离子方程式:_________(如果不能此问不作答)
(2)某同学探究溶液的导电性与离子浓度的关系,做了实验,滴定管是用于滴加溶液的仪器。

①若烧杯中所盛液体是NaHSO4溶液,滴定管内是Ba(OH)2溶液,随着Ba(OH)2溶液的滴加,灯泡逐渐变暗,当滴加至溶液呈中性时的离子方程式:_______,继续滴加,发生反应的离子方程式为:__________。
②下列哪种组合可使滴加过程中灯泡先变亮后变暗_______
A 向醋酸中滴加相同浓度的氨水
B 石灰乳中滴加稀盐酸
C 向盐酸中滴加相同浓度的氢氧化钠溶液
D 向醋酸钠溶液中滴加相同浓度的盐酸至过量
③若将NaHSO4换成NH4HSO4溶液,加入足量的Ba(OH)2溶液,发生反应的离子方程式为__________。
【答案】AC NaHSO4=== Na++HSO4- 能 2H+ +Mg=== Mg2+ + H2↑ 2H+ + SO42- +Ba2+ +2OH- === BaSO4 ↓+ 2H2O SO42- +Ba2+ === BaSO4↓ A NH4+ +H+ + SO42- +Ba2+ +2OH- === BaSO4 ↓+ NH3H2O +H2O
【解析】
(1)NaHSO4晶体由Na+和HSO4-结合而成,属于钠盐,也是硫酸的酸式盐,在熔融状态下的电离方程式为:NaHSO4=== Na++HSO4-,在水中的电离方程式为:NaHSO4 === Na+ + H+ + SO42-,所以NaHSO4水溶液能与Mg反应,离子方程式为:2H+ +Mg=== Mg2+ + H2↑。答案为:AC;NaHSO4=== Na++HSO4-;能;2H+ +Mg=== Mg2+ + H2↑
(2)①NaHSO4溶液中滴加Ba(OH)2溶液至呈中性时,H+和OH-恰好完全反应,则NaHSO4和Ba(OH)2按2:1反应,H+ 消耗完,SO42-有剩余,离子方程式为:2H++ SO42-+Ba2++2OH- === BaSO4 ↓+ 2H2O,继续滴加,SO42-和Ba2+反应,离子方程式为:SO42- +Ba2+=== BaSO4 ↓。答案为:2H+ + SO42- +Ba2+ +2OH- === BaSO4↓+ 2H2O;SO42- +Ba2+=== BaSO4↓
②A. 向醋酸中滴加相同浓度的氨水,变化为:先是弱电解质醋酸→强电解质醋酸铵,离子浓度增大,导电性增强,灯泡先变亮;醋酸反应完后,继续加入的氨水为弱电解质溶液,导电性差,所以溶液导电性减弱,灯泡变暗;A选项符合题意;
B. 石灰乳中滴加稀盐酸,由于微溶的Ca(OH)2变为易溶的强电解质CaCl2,使得溶液中离子浓度增大,导电性增强,灯泡变亮;过量的盐酸导电性不弱于生成的CaCl2溶液,所以盐酸过量后导电性不下降,B选项不符合题意;
C. 向盐酸中滴加相同浓度的氢氧化钠溶液,变化为:先是强电解质HCl→强电解质NaCl,但溶液体积变大,离子浓度减小,导电性略减弱,灯泡先变暗;反应完后,继续加入氢氧化钠溶液,离子浓度增大,导电性略增强,灯泡变亮,灯泡不变暗;C选项不符合题意;
D. 向醋酸钠溶液中滴加相同浓度的盐酸至过量,变化为:先是CH3COONa + HCl === CH3COOH + NaCl,强电解质CH3COONa→弱电解质CH3COOH和强电解质NaCl,同时溶液体积变大,离子浓度减小,导电性略减弱,灯泡先变暗;醋酸钠反应完后,继续加入相同浓度的盐酸,导电性略增强,灯泡变亮,D选项不符合题意;答案为:A
③NH4HSO4溶液中加入足量的Ba(OH)2溶液,NH4HSO4完全反应,即,参加反应的NH4+、H+、SO42-个数比为1:1:1,则该反应的离子方程式为:NH4++H++ SO42-+Ba2++2OH-=== BaSO4 ↓+ NH3H2O +H2O。答案为:NH4++H++ SO42-+Ba2++2OH-=== BaSO4 ↓+ NH3H2O +H2O


科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
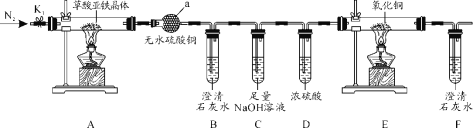
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
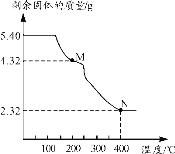
①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)根据下列变化关系:

请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:___;
(2)该反应的正反应为__反应(“吸热”或“放热”);
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是__(填代号)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
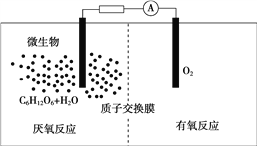
A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的分子,下列叙述正确的是( )
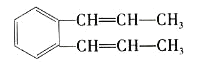
A.该分子最多有22个原子在同一平面内
B.1mol该物质完全燃烧消耗16molO2
C.除苯环外的其余碳原子有可能在一条直线上
D.1mol该物质与足量溴水反应,最多消耗5molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下各种情况下排序正确的是( )
A.当它们的体积、温度和压强均相同时,三种气体的密度ρ(H2)>ρ(Ne)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强p(H2)>p(Ne)>p(O2)
C.当它们的质量、温度和压强均相同时,三种气体的体积V(O2)>V(Ne)>V(H2)
D.当它们的压强、体积和温度均相同时,三种气体的质量m(H2)>m(Ne)>m(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com