
| A、纯铝 | B、钢化玻璃 |
| C、沙子 | D、镁铝合金 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
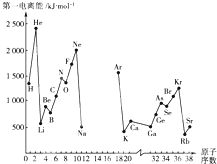 根据信息回答列问题:
根据信息回答列问题:| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| B、二氧化硫有漂白性,可用于加工食品使食品增白 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 400℃ |
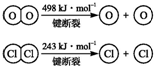
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Na+ | Cl- | OH- | Hg2+ |
| 浓度(mol/L) | 3×10-5 | 2×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧碱溶液与碳酸氢钠溶液:HCO3-+OH-=H2O+CO2↑ |
| B、氧化钠与盐酸:O2-+2H+=H2O |
| C、碳酸氢钠与稀硫酸:CO32-+2H+=H2O+CO2↑ |
| D、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com