
【题目】已知合成氨反应N2(g)+3H2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a、b、c如图所示.下列说法正确的是( )
A.曲线a对应的反应温度最高
B.上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q)<K(N)
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
D.N点时c(NH3)=0.2mol/L,则N点的c(N2):c(NH3)=1:1
【答案】D
【解析】A、正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小,而a点氨的体积分数最大,所以曲线a对应的反应温度最低,故A错误;
B、K只受温度影响,温度不变平衡常数不变,所以K(M)=K(Q),正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,Q点的温度低于N,所以K(Q)>K(N),故B错误;
C、相同压强下,投料相同,温度越高反应速率越快,达到平衡消耗时间越短,cba的温度依次降低,所以达到平衡消耗时间关系为a>b>c,故C错误;
D、N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a﹣ab 3a﹣3ab 2ab
根据题意有 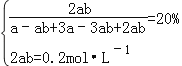 ,所以a=0.3molL﹣1 , b=
,所以a=0.3molL﹣1 , b= ![]() ,则N点的c(N2):c(NH3)=(0.3﹣0.3×
,则N点的c(N2):c(NH3)=(0.3﹣0.3× ![]() ):2×0.3×
):2×0.3× ![]() =0.2:0.2=1:1,故D正确;
=0.2:0.2=1:1,故D正确;
故选:D.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅的说法正确的是( )
①硅在自然界中以游离态和化合态两种形式存在 ②水泥是硅酸盐材料 ③单质硅是良好的半导体 ④氮化硅陶瓷是新型的无机非金属材料 ⑤光导纤维属于硅酸盐产品 ⑥水玻璃可以用作木材防火剂
A. ①③④⑥ B. ②③④⑤ C. ①②⑤⑥ D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.76g部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO),经如下处理,下列说法正确的是( ) 
A.V=224
B.样品中Fe的质量为2.14 g
C.未氧化前Fe元素的质量分数约为41.2%
D.样品中CuO的质量为3.52 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的有关叙述错误的是( )
选项 | A | B | C | D |
实验装置图 |
|
|
|
|
实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们质量总和不到体里的千万分之,但是对人的健康却起着重要作用,下列各组元素全部是微量元素的是( )
A. K、CL、S、OB. Mn、Fe、Zn、Cu
C. N、H、P、CD. K、Ca、C、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,盛有催化剂的体积一定的密闭容器中,通入一定量的SO3气体,发生分解反应2SO32SO2+O2 , 并达到平衡状态,测得SO3的分解率为75%.下列说法正确的是( )
A.平衡后的压强为起始压强的1.25倍
B.平衡时混合气体的平均相对分子质量为64
C.混合气体的密度自始至终保持不变
D.取和SO3等质量的SO2和O2的混合气体,从逆反应开始并达到平衡,在相同条件下各物质的浓度与原来的平衡浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72﹣ , 处理该废水常用的流程如图1所示:
Na2S2O3在此过程中表现性.若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为价,反应的离子方程式为 .
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车.其反应原理如下,请配平该反应方程式:CrO3+CH3CH2OH+H2SO4﹣CH3CHO+Cr2(SO4)3+H2O
(3)已知存在平衡:2CrO42﹣+2H+Cr2O72﹣+H2O.向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为(任意写出其中一种即可).此时溶液中c(Pb2+):c(Ba2+)= .
已知Ksp(BaCrO4)=1.25×10﹣10;Ksp(PbCrO4)=2.75×10﹣13
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7 , 制备装置如图2所示(阳离子交换膜只允许阳离子透过).通电后阳极的电极反应式为 . 请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去;优氯净中氯元素的化合价为;无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另一固体.请写出无水亚硫酸钠受热分解的反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com