
分析 (1)非金属性O>Cl>C,非金属性越强电负性越大;
(2)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(3)分子晶体熔沸点较低;
(4)单键都是σ键,双键和三键都是只有一个σ键;
(5)①根据价层电子对互斥理论确定其杂化类型;
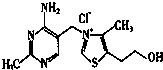
②维生素B,晶体溶于水的过程中要克服的微粒间的作用力有分子间作用力和离子键;
(6)酸式盐在水中电离产生的酸式根离子与离子之间形成氢键,溶解度大于正盐,CO32-比HCO3-多一个负电荷,水合作用强于HCO3-,而且HCO3-的H进入到CO3电子云程度很大,使CO3的负电荷进一步被中和,水合作用进一步降低,所以Na2CO3比NaHCO3的溶解度大.
解答 解:(1)非金属性越强电负性越大,非金属性O>Cl>C,所以电负性:O>Cl>C,故答案为:O>Cl>C;
(2)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(3)分子晶体熔沸点较低,该物质的熔沸点较低,所以为分子晶体,故答案为:分子晶体;
(4)单键都是σ键,双键和三键都是只有一个σ键,CH3COOH中含有3个H-C键,1个C-Cl键,1个O-C键,1个O=C键,1个H-O键,故共有7个σ键,所以1mol CH3COOH中含有的σ键的数目为7mol,故答案为:7mol;
(5)①该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化,故答案为:sp2、sp3;
②维生素B,晶体溶于水的过程中要克服的微粒间的作用力有范德华力、氢键和离子键,故选D;
(6)酸式盐在水中电离产生的酸式根离子与离子之间形成氢键,溶解度大于正盐,CO32-比HCO3-多一个负电荷,水合作用强于HCO3-,而且HCO3-的H进入到CO3电子云程度很大,使CO3的负电荷进一步被中和,水合作用进一步降低,所以Na2CO3比NaHCO3的溶解度大,
故答案为:酸式根离子与离子之间形成氢键,CO32-比HCO3-多一个负电荷,水合作用强于HCO3-,而且HCO3-的H进入到CO3电子云程度很大,使CO3的负电荷进一步被中和,水合作用进一步降低,所以Na2CO3比NaHCO3的溶解度大.
点评 本题考查了元素的电负性、价电子排布式的书写、分子结构的判断等知识点,知识点碎而多,要求学生会利用知识迁移的方法分析问题,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 气体 | a | b | c | 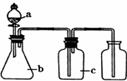 |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
| C | NO | 稀硝酸 | 铜屑 | H2O | |
| D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. ,反应类型酯化反应.
,反应类型酯化反应. )
) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每个四氢大麻酚分子中含有3个手性碳原子 | |
| B. | 四氢大麻酚能与FeCl3溶液发生显色反应 | |
| C. | 1mol四氢大麻酚最多可与1molBr2发生加成反应 | |
| D. | 1mol四氢大麻酚与NaOH溶液反应,最多消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子半径:d3+<f- | |
| B. | 原子失电子能力:c>d | |
| C. | 最简单气态氢化物的热稳定性:a<e | |
| D. | b、c两元素可组成既含离子键又含共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙:
乙:
| 分子式 | C9H8O |
| 部分性质 | 能使Br2CCl4褪色 |
 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙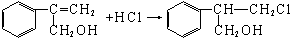 (不需注明反应条件).
(不需注明反应条件).
 .
. 、
、 、
、 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
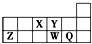
| A. | 离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Q的强 | |
| C. | 元素X与Q的氢化物化合的产物中既含共价键又含离子键 | |
| D. | X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、Na+、SO42- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Mg2+、Na+、Cl-、NO3- | D. | Ba2+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com