
【题目】下列各组物质间可能包括多步反应,其总的离子方程式正确的是 ( )
A. 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO3-
B. 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 向 AlCl3溶液中投入过量Na:Al3++4Na+2H2O===AlO2-+4Na++2H2↑
D. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
【答案】C
【解析】
A.二氧化硫被次氯酸氧化;
B.氯气少量,亚铁离子被氯气氧化;
C.钠与水反应生成了氢氧化钠,过量的氢氧化钠与铝离子反应生成了偏铝酸根离子;
D.根据硫酸根离子与钡离子满足物质的量1:1分析.
A.次氯酸具有强氧化性,发生氧化还原反应,反应的离子方程式为:ClO-+SO2+H2O═2H++Cl-+SO42-,故A错误;
B.向FeBr2溶液中通入少量Cl2,亚铁离子被氯气氧化,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故B错误;
C.向AlCl3溶液中投入过量Na,反应生成了偏铝酸根离子和氢气,反应的离子方程式为Al3++4Na+2H2O═AlO2-+4Na++2H2↑,故C正确;
D.溶液中钡离子与硫酸根离子的物质的量相等,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═AlO2-+2H2O+2BaSO4↓,故D错误;
答案:C。


科目:高中化学 来源: 题型:
【题目】标准状况下,VL氨气溶解在1L水中(水的密度近似为lg/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ρ=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
I.某化学兴趣小组对下列三组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.溶液、水、悬浊液、胶体
C.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
请你帮他们完善下列空白:
A | B | C | |
分类标准 | 含氧酸 | 分散系 | (3) |
不属于该类别的物质 | (1) | (2) | Na2CO3 |
II.“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
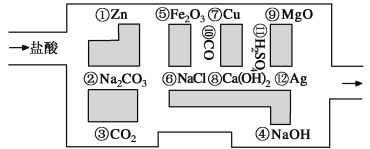
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是____________,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
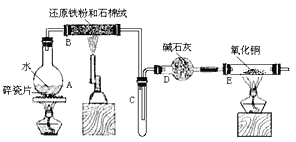
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作是 ________________。 装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C中玻璃管处点燃该气体,则必须对该气体行________________,装置E中的现象是 _______________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 _____________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
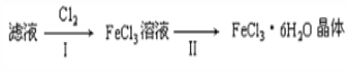
① 步骤I中通入Cl2的作用是__________________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
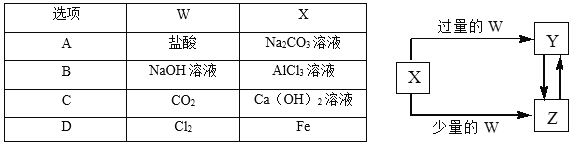
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
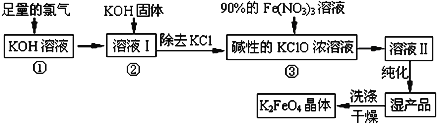
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2 =5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)的情况下进行;
(2)在溶液I中加入KOH固体的目的是________(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________________________________ 。
(4)如何判断K2FeO4晶体已经洗涤干净________________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为( )
A. 用稀盐酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS===H2S↑+Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-===Al2(CO3)3↓
D. Na2O2溶于水产生O2∶Na2O2+H2O===2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:
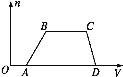
(1)溶液中一定含有的溶质是______________________(填化学式)。
(2)溶液中一定不含有的溶质是________________(填化学式)。
(3)溶液中可能含有的溶质是____(填名称),判断该物质是否存在的实验方法是____,若存在则现象是_______________________________________________。
(4)分别写出AB段、BC段发生反应的离子方程式:
①AB段为_______________________________________________________________;
②BC段为_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com