
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,据此回答下列问题。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___________方法区分晶体、准晶体和非晶体;
(2)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是__________________________;Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子;
(3)经验规律告诉我们,当成键的两个原子电负性χ的差值Δχ大于1.7时,原子间一般形成的是离子键;Δχ小于1.7时,原子间一般形成的是共价键。已知χ(Fe)=1.8,χ(Cl)=3.1,据此推断化合物FeCl3中Fe-Cl键的共用电子对偏向______原子(填名称),FeCl3属于__________(填“共价化合物”或“离子化合物”);
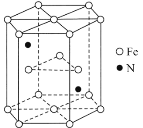
(4)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为__________ g/cm3(用代数式表示)。
【答案】X-射线衍射 Cu2O中Cu+的3d轨道处于全满的稳定状态,而CuO中Cu2+的3d轨道排布为3d9,能量高,不稳定 16 氯 共价化合物 ![]()
【解析】
(1)晶体对X-射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;(2)在Cu2O中Cu+原子处于d轨道的全满的稳定状态,而若再失去1个电子变为不稳定状态;计算出该晶胞中O原子数,再由Cu2O中Cu和O的比例判断该晶胞中铜原子数;
(3) 氯原子吸引电子的能力大于铁原子,结合Δχ=χ(Cl) -χ(Fe)=3.1-1.8=1.3<1.7分析解答;
(4)根据均摊法计算晶胞中原子数目,再计算晶胞质量m,和晶胞体积V,根据晶体密度ρ=![]() 计算。
计算。
(1)从外观无法区分晶体、准晶体和非晶体,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,故答案为:X-射线衍射;
(2)在Cu2O中Cu+原子的核外电子排布为1s22s22p63s23p63d10,处于d轨道的全满的稳定状态,而若再失去1个电子变为Cu2+时1s22s22p63s23p63d9,是不稳定的状态,CuO在高温时分解为O2和Cu2O;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个,故答案为:Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定;16;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个,故答案为:Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定;16;
(3) Δχ=χ(Cl) -χ(Fe)=3.1-1.8=1.3<1.7,化合物FeCl3中Fe-Cl键为共价键,FeCl3属于共价化合物,氯原子吸引电子的能力大于铁原子,共用电子对偏向氯原子,故答案为:氯;共价化合物;
(4)图中结构单元底面为正六边形,边长为a cm,底面面积为6×![]() ×a cm×a cm×sin60°=
×a cm×a cm×sin60°=![]() a2cm2;结构单元的体积V=
a2cm2;结构单元的体积V=![]() a2cm2×c cm=
a2cm2×c cm=![]() a2 c cm3,结构单元中含有N原子数为2,含有的Fe原子数为:12×
a2 c cm3,结构单元中含有N原子数为2,含有的Fe原子数为:12×![]() +2×
+2×![]() +3=6,该晶胞的质量m=
+3=6,该晶胞的质量m=![]() =
=![]() g,所以该晶体密度ρ=
g,所以该晶体密度ρ=![]() =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
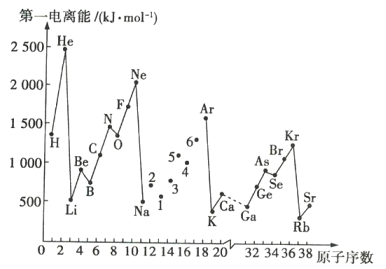
【题目】第一电离能是指处于基态的气态原子失去一个电子,生成+1价气态阳离子所需要的能量。如图是部分元素的第一电离能I1随原子序数变化的曲线图。
请回答下列问题:
(1)分析图中同周期元素第一电离能的变化规律,将Na~Ar之间1~6号元素用短线连接起来,构成完整的图象___。
(2)根据图分析可知,同主族元素的第一电离能的变化规律是___。
(3)图中5号元素在元素周期表中的位置是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)![]() 中含有的官能团为__。
中含有的官能团为__。
(2)CH2=CH-CH3加聚产物的结构简式是___。
(3)键线式![]() 表示的分子式__;
表示的分子式__;
(4)有机物(CH3)3CCH2CH(C2H5)CH3其系统命名法名称应为___。
(5)在下列有机物①CH3CH2CH3;②CH3-CH=CH2;③CH3-C![]() CH;④
CH;④![]() ;⑤(CH3)2CHCH3;⑥
;⑤(CH3)2CHCH3;⑥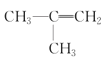 ;⑦
;⑦![]() ;⑧
;⑧![]() ;⑨
;⑨![]() ,⑩CH3CH2Cl中,属于饱和烃的是__,互为同系物的是__,互为同分异构体的是__。(填写序号)
,⑩CH3CH2Cl中,属于饱和烃的是__,互为同系物的是__,互为同分异构体的是__。(填写序号)
(6)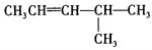 的系统命名法名称是 ___;
的系统命名法名称是 ___;
(7)3,4,4—三甲基—1—戊炔的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展 的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如图所示:
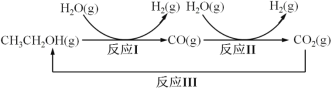
(1)已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应 I 的热化学方程式____________。
(2)反应 II,在进气比[n(CO) : n(H2O)]不同时,测得相应的 CO 平衡转化率见图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

①经分析,A、E 和 G 三点对应的反应温度相同,其原因是 KA=KE=KG=____________(填数值)。在该温度下:要提高 CO平衡转化率,除了改变进气比之外,还可采取的措施是____________。
② 对比分析 B、E、F 三点,可得出对应的进气比和反应温度的变化趋势之间的关系是____________。
③ 比较 A、B 两点对应的反应速率大小:VA____________VB(填“<” “=”或“>”)。已知反应速率 v=v 正v 逆= k正X(CO)X(H2O)-k逆X(CO2)X(H2),k 正、k 逆分别为正、逆向反应速率常数,X为物质的量分数计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时,![]() =_____________(计算结果保留1位小数)。
=_____________(计算结果保留1位小数)。
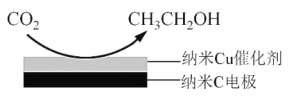
(3)反应 III 利用碳酸钾溶液吸收 CO2 得到饱和 KHCO3 电解液,电解活化的 CO2 来制备乙醇。
①已知碳酸的电离常数 Ka1=10-a mol·L1,Ka2=10-b mol·L1,吸收足量 CO2 所得饱和 KHCO3 溶液的 pH=c,则该溶液中lg![]() =________________
=________________
②在饱和 KHCO3 电解液中电解 CO2 来制备乙醇的原理如图所示。则阴极的电极反应式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
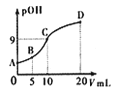
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中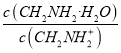 =2.5×10-5
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 分子的结构是由键角决定的
B. H2O分子中的两个O—H键的键角为180°
C. CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素的原子序数依次增大,A 的一种核素在考古时常用来鉴定一些文物的年代,B的气态氢化物的水溶液呈碱性;C为金属元素且有两种常见含氧化合物(都含两种元素);若往D单质的水溶液中滴加少量紫色石蕊溶液,可观察到先变红后褪色。下列说法中正确的是( )
A.C的两种含氧化合物中阴、阳离子个数比都为1∶2
B.最高价氧化物对应的水化物的酸性:B>D
C.B的氢化物的沸点一定高于A的氢化物
D.电负性:D>B>A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
A.方案①用于分离I2和NH4I固体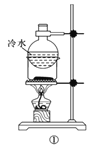
B.方案②用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热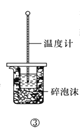
D.方案④用于比较醋酸和硼酸的酸性强弱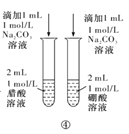
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国康乃尔大学的威考克斯(C·Wilcox)所合成的一种有机分子就像一尊释迦牟尼佛像,因而称为释迦牟尼分子(分子中所有原子均在同一平面)如图。对于该有机物的叙述正确的是
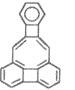
①该有机物属于芳香烃;②该有机物的分子式为C22H12; ③该有机物能发生加成反应;④该有机物的一氯代物的同分异构体有6种
A. ①③④B. ①②C. ②③D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com