
���� ��1��Ũ��������10.8gΪ����ˮ����������ʯ������17.6gΪȼ�����ɶ�����̼��������������̼��C��ÿ��Oԭ��֮�乲���������Ӷԣ�
��2��Ũ��������ˮ����ʯ�����ն�����̼��n��H2O��=$\frac{10.8g}{18g/mol}$=0.6mol��n��CO2��=$\frac{17.6g}{44g/mol}$=0.4mol������Hԭ���غ��n��H��=2n��H2O��=1.2mol������Cԭ���غ��n��C��=n��CO2��=0.4mol��Ҫȷ�����л�����ɻ�����֪��Oԭ�ӵ����ʵ�����
��3�����ݣ�2��֪��0.2mol�л����к���0.4molC��1.2molHԭ�ӣ���÷����к���2��Cԭ�ӡ�6��Hԭ�ӣ������л�����������ģ�������к���1��Oԭ�ӣ��������Ҵ�Ҳ�����Ƕ����ѣ�������һ��ͬ���칹����������ˮ���ܼ�������������Ʒ�Ӧ�����������ᷴӦ���������Ϊ�Ҵ����Ҵ���������Ũ���������������������·���������Ӧ��������������
��� �⣺��1��Ũ��������10.8gΪ����ˮ����������ʯ������17.6gΪȼ�����ɶ�����̼��������������̼��C��ÿ��Oԭ��֮�乲���������Ӷԣ���ṹʽΪO=C=O���ʴ�Ϊ��O=C=O��
��2��Ũ��������ˮ����ʯ�����ն�����̼��n��H2O��=$\frac{10.8g}{18g/mol}$=0.6mol��n��CO2��=$\frac{17.6g}{44g/mol}$=0.4mol������Hԭ���غ��n��H��=2n��H2O��=1.2mol������Cԭ���غ��n��C��=n��CO2��=0.4mol������C��Hԭ�Ӽ���ֵ��Ҫȷ�����л�����ɻ�����֪��Oԭ�ӵ����ʵ������ʴ�Ϊ����ԭ�ӵ����ʵ�����
��3�����ݣ�2��֪��0.2mol�л����к���0.4molC��1.2molHԭ�ӣ���÷����к���2��Cԭ�ӡ�6��Hԭ�ӣ������л�����������ģ�������к���1��Oԭ�ӣ�����ʽΪC2H6O���������Ҵ�Ҳ�����Ƕ����ѣ�������һ��ͬ���칹����������ˮ���ܼ�������������Ʒ�Ӧ�����������ᷴӦ���������ΪCH3CH2OH���Ҵ���������Ũ���������������������·���������Ӧ����������������Ӧ����ʽΪCH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��
�ʴ�Ϊ��C2H6O��2��CH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��
���� ���⿼���л������ʽȷ���ļ��㣬Ϊ��Ƶ���㣬�漰����ʽ����д���л������ʽ��ȷ�����ṹʽ����д��֪ʶ�㣬��ȷ����������֮��Ĺ�ϵ���л��������ǽⱾ��ؼ������ؿ���ѧ����������������ע��ԭ���غ��Ӧ�ã���Ŀ�ѶȲ���


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ģ��Ϊ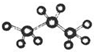 | B�� | ��ϩ�Ľṹ��ʽΪCH3CHCH2 | ||
| C�� | ����ͨʽCnH2n+2��һ�������� | D�� | O2��O3����ͬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+ | B�� | CH4 | C�� | SO2 | D�� | CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | Na | Na2O2 | NaOH |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
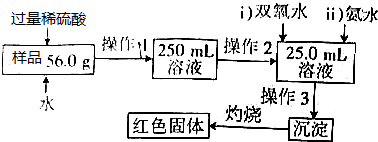
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 500mL | B�� | 600mL | C�� | 650mL | D�� | 700mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������� | ���ᴿ����ʣ� | �Լ� | ���뷽�� |
| �� | CH3CH3��CH2=CH2�� | ||
| �� | CH2=CH2��SO2�� | ||
| �� | �������������ᣩ | ||
| �� | �Ҵ���ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȡ�ܽ�����Һ�������ȼ�������ˮ���ټ�KSCN����Ѫ��ɫ��Һ������Fe2+ | |
| B�� | ����3�����ӷ���ʽΪ��5C2O42-+2MnO${\;}_{4}^{-}$+8H2O=10CO2��+2Mn2++16OH- | |
| C�� | x��z=1��2 | |
| D�� | �þ���Ļ�ѧʽΪ��K3[Fe��C2O4��3]•3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٣��ڣ��ۣ��ܣ��� | B�� | �ڣ��٣��ݣ��ܣ��� | C�� | �ۣ��ܣ��ݣ��٣��� | D�� | �ݣ��ܣ��ۣ��ڣ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com