
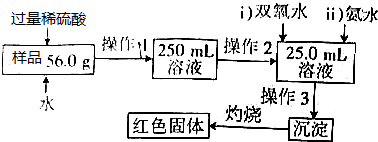
分析 氧化铁样品中含有少量的杂质FeSO4,加入过量稀硫酸和水溶解反应得到硫酸铁和硫酸亚铁混合溶液,配制250.00ml溶液,用滴定管量取25ml溶液加入过氧化氢氧化亚铁离子,加入过量氨水沉淀铁离子,过滤洗涤得到氢氧化铁沉淀,灼烧得到红棕色固体为氧化铁,
(1)氧化铁与稀硫酸反应生成硫酸铁和水;
(2)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁;
(3)操作3用于分离固体和液体;
(4)如氨水过量,则溶液呈碱性,可用pH试纸测量;
(5)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×$\frac{112g}{160g/mol}$=(47.0g-42.6g)×$\frac{112g}{160g/mol}$=3.08g;
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{250}{25}$;
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{500}{50}$=30.8g,最后求样品中铁元素的质量分数.
解答 解:氧化铁样品中含有少量的杂质FeSO4,加入过量稀硫酸和水溶解反应得到硫酸铁和硫酸亚铁混合溶液,配制250.00ml溶液,用滴定管量取25ml溶液加入过氧化氢氧化亚铁离子,加入过量氨水沉淀铁离子,过滤洗涤得到氢氧化铁沉淀,灼烧得到红棕色固体为氧化铁
(1)氧化铁与稀硫酸反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)由于加双氧水的目的就是让+2价铁变为+3价,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)操作3用于分离固体和液体,为过滤操作,故答案为:过滤;
(4)如氨水过量,则溶液呈碱性,可用pH试纸测量,方法是将试纸防止玻璃片,用玻璃棒蘸取溶液与pH试纸上,如试纸变蓝色,说明氨水过量,也可滴加硫酸铁溶液,观察是否生成红褐色沉淀,
故答案为:将试纸防止玻璃片,用玻璃棒蘸取溶液与pH试纸上,如试纸变蓝色,说明氨水过量;
(5)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×$\frac{112g}{160g/mol}$=(47.0g-42.6g)×$\frac{112g}{160g/mol}$=3.08g;
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{250}{25}$;
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×$\frac{112g}{160g/mol}$×$\frac{500}{50}$=30.8g;
w(Fe)=$\frac{m(Fe)}{m(样品)}$×100%=$\frac{30.8g}{56.0g}$×100%=55.0%,
故答案为:55.0%.
点评 本题考查了物质组成的分析判断,为高频考点,侧重于学生的分析、实验和计算能力的考查,实验探究方法和实验过程分析,元素守恒的计算应用,误差分析和量具的精确度理解,题目难度中等.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:解答题
 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.| ② | |||
| ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用分液漏斗分离乙醛与水的混合物 | |
| B. | 可用溴水一次全部鉴别出苯、乙醇、1-己烯、福尔马林和苯酚溶液 | |
| C. | 提纯苯甲酸(含有食盐固体)可采用溶解、过滤、蒸馏的方法 | |
| D. | 煤油、柴油、花生油、猪油的主要成分均为酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | C2H5OH | C. | CrO3 | D. | Cr2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不能确定该物质的最简式 | B. | 肯定能确定该物质的最简式 | ||
| C. | 肯定不能确定该物质的分子式 | D. | 肯定不能确定该物质的结构式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com