
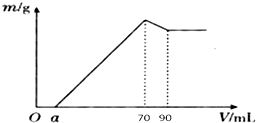
分析 根据Al2O3是两性氧化物,既溶液强酸又溶于强碱;Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸;铝土矿样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,所得溶液中含有Al3+、Fe3+,由图象可知,向滤液中加入10mol•L-1的NaOH溶液,没有沉淀生成,说明硫酸有剩余,继续加入NaOH溶液,铁离子变成氢氧化铁沉淀,将铝离子变成为氢氧化铝沉淀,当加入氢氧化钠共70mL时,沉淀量最大,此时溶液中溶质为硫酸钠,根据钠离子守恒计算硫酸钠的物质的量,再根据硫酸根守恒计算原硫酸溶液中n(H2SO4),再根据c=$\frac{n}{V}$计算;
从70mL~90mL加入的10mL氢氧化钠完全溶解氢氧化铝,发生反应:Al(OH)3+OH-=AlO2-+2H2O,最后剩余固体为氢氧化铁,根据n=cV计算该阶段消耗的n(NaOH),再根据方程式计算氢氧化铝的物质的量,利用铝元素守恒计算n(Al2O3),根据m=nM计算氧化铝的质量,根据质量分数定义计算;
利用铝元素守恒计算溶液中n(Al3+),进而计算铝离子完全沉淀消耗的氢氧化钠的物质的量,根据n=cV计算铁离子、铝离子完全消耗的n(NaOH),进而计算n(Fe3+),利用铁元素守恒计算n(Fe2O3),根据m=nM计算氧化铁的质量,最终再计算SiO2的质量分数.
解答 解:(1)加入氢氧化钠70mL时,沉淀量最大,此时溶液溶质为硫酸钠,根据Na元素守恒有n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.07L×10mol•L-1=0.35mol,根据硫酸根守恒,则有:n(H2SO4)=0.35mol,
所以原硫酸溶液中c(H2SO4)=$\frac{0.35mol}{0.1L}$=3.5mol/L,
故答案为:3.5mol/L;
(2)从70mL~90mL加入的20mL氢氧化钠完全溶解氢氧化铝,该阶段消耗的n(NaOH)=0.02L×10mol•L-1=0.2mol,根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.2mol,故溶液中n(Al3+)=0.2mol,根据Al元素守恒可知n(Al2O3)=$\frac{1}{2}$×0.2mol=0.1mol,则m(Al2O3)=0.1mol×102g/mol=10.2g;
铝离子完全沉淀消耗氢氧化钠的物质的量为0.2mol×3=0.6mol,铁离子、铝离子完全沉淀消耗的氢氧化钠溶液的体积为70mL-4.6mL=65.4mL,故该阶段消耗n(NaOH)=0.0654L×10mol/L=0.654mol,故铁离子完全沉淀消耗的氢氧化钠的物质的量为0.654mol-0.6mol=0.054mol,
则铁离子完全沉淀消耗的氢氧化钠的体积为V=$\frac{n}{c}$=$\frac{0.054mol}{10mol/L}$=0.0054L=5.4ml,故n(Fe3+)=$\frac{0.054mol}{3}$=0.018mol,故m(Fe2O3)=0.018mol×$\frac{1}{2}$×160g/mol=1.44g,m(SiO2)=12-1.44-10.2=0.36g;
铝土矿中各组成成分的质量分数为:Al2O3 为$\frac{10.2g}{12g}$×100%=85%,SiO2 为$\frac{0.36g}{12g}$×100%=3%;
故答案为:5.4; 85%; 3%.
点评 本题考查混合物的有关计算,侧重于学生的分析能力和计算能力的考查,难度中等,清楚图象中各阶段发生的反应是关键,注意根据守恒的计算,(1)中注意利用反应判断沉淀最大值时,溶液中的溶质,再利用守恒计算,可以简化计算过程.


科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 原子半径:Na>Mg | ||
| C. | 热稳定性:HCl>HI | D. | 还原性:S2->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融态的Al2O3导电、12C转化为14C都属于化学变化 | |
| B. | 根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 | |
| C. | 用热的纯碱溶液洗涤沾有油污的器具时涉及化学变化和物理变化 | |
| D. | 将盛有NO2气体的密封烧瓶,放入热水中气体颜色加深的变化是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
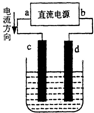
| A. | a为正极 | |
| B. | c极上发生氧化反应 | |
| C. | 电解过程中铜离子移向d极 | |
| D. | 电解过程中,d的电极反应式为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
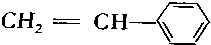
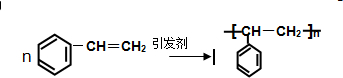 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com