
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1)途径I碱浸时发生反应的化学反应方程式为________________________________________。
(2)途径II氧化时还有Na2SO4生成,则反应的离子方程式为_____________________________。
(3)已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____________[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的气体一起通入水中,得到正盐的化学式是__________________________。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是________________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M=206g/mol) 的物质的量浓度为__________________(计算结果保留3位有效数字)。
(6)二硫化钼用作电池的正极材料时接受Li+的嵌入,锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时正极的电极反应是:_____________________。
Lix(MoS2)n。则电池放电时正极的电极反应是:_____________________。
【答案】 MoO3+Na2CO3=Na2MoO4+CO2↑ MoS2+9ClO-+6OH-=MoO42-+9Cl-+2 SO42-+3H2O 90% (NH4)2CO3和(NH4)2SO3 常温下浓硫酸会使铁钝化 7.28×10-4mol/L nMoS2+xLi++xe-=Lix(MoS2)n
【解析】利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体。
(1)根据题给流程图分析途径I碱浸时,MoO3与碳酸钠溶液反应生成二氧化碳和Na2MoO4,发生反应的化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑;
(2)途径Ⅱ氧化时MoS2与次氯酸钠、氢氧化钠溶液反应生成Na2MoO4和硫酸钠,利用化合价升降法结合原子守恒和电荷守恒配平,发生反应的离子方程式为MoS2+9ClO-+6OH-====MoO42-+9Cl-+3H2O;
(3)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=![]() =1×10-7mol/L,溶液中碳酸根离子的浓度为:c(SO42-)=
=1×10-7mol/L,溶液中碳酸根离子的浓度为:c(SO42-)=![]() =1×10-2mol/L,所以碳酸根离子的去除率为:1
=1×10-2mol/L,所以碳酸根离子的去除率为:1![]() =1-10%=90%;故CO32-的去除率是90%;
=1-10%=90%;故CO32-的去除率是90%;
(4)钼酸铵[(NH4)2MoO4]和氢氧化钠反应生成钼酸钠和氨气,将氨气与途径I所产生的尾气CO2、SO2一起通入水中,得到正盐的化学式是(NH4)2CO3、(NH4)2SO3;
(5)①浓硫酸具有强氧化性,常温下能使铁钝化。故当硫酸的浓度大于90%时,腐蚀速率几乎为零;
②根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,缓蚀效果最好,
所以钼酸钠的浓度为:150mgL-1,1L溶液中含有的钼酸钠物质的量为: ![]() ≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1,故答案为:7.28×l0-4molL-1;(6)根据锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1,故答案为:7.28×l0-4molL-1;(6)根据锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,可知锂是还原剂,在负极发生氧化反应,负极反应式为:xLi-xe-=xLi+,是氧化剂在正极发生还原反应,据此书写电池放电时的正极反应式:正极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n。
Lix(MoS2)n,可知锂是还原剂,在负极发生氧化反应,负极反应式为:xLi-xe-=xLi+,是氧化剂在正极发生还原反应,据此书写电池放电时的正极反应式:正极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n。


科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(结构式如图所示)属于欧盟批准使用的食品添加剂。亚铁氰化钾不稳定,受热易分解:3K4[Fe(CN)6]![]() 12KCN+Fe3C+2(CN)2↑+N2↑+C;K4[Fe(CN)6]+K2CO3
12KCN+Fe3C+2(CN)2↑+N2↑+C;K4[Fe(CN)6]+K2CO3![]() 5KCN+KOCN+Fe+CO2↑。
5KCN+KOCN+Fe+CO2↑。

(1)基态Fe原子的未成对电子数为___________;K4[Fe(CN)6]中Fe2+与CN-的中心原子形成的化学键类型为_________________,提供孤电子对的成键原子是________________。
(2)KOCN中阴离子OCN-的几何构型为__________,中心原子的杂化轨道类型为___________。O、C、N的第一电离能从大到小的顺序为_________________,电负性从大到小的顺序为___________________。
(3)(CN)2的结构式为_______________________。
(4)KCN的晶体结构如图所示,已知晶胞参数a=0.648nm。则K+的配位数为__________,紧邻的两个K+的距离为_____cm,该晶体的密度为______________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验时必须要有安全意识,下列做法错误的是
A.加热试管或烧杯时,应首先擦干外壁上的水
B.不慎将浓碱溶液溅到皮肤上,要立即用大量水冲洗,然后再涂硼酸溶液
C.温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
D.酒精及其它易燃有机物小面积失火,应迅速用湿抹布扑灭,烫伤(灼伤)要就医
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法不正确的是( )
A.常温常压下,32gO2和32gO3所含氧原子数都是2NA
B.同温、同压下,相同体积的氟气和氩气所含的原子数相等
C.18g D2O含有的电子数为9NA
D.2.4g金属镁变成镁离子时失去的电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相似相溶(经验规律):一般来说,由极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。以下可以用相似相溶规律说明的是( )
A. Cl2可溶于水 B. I2可溶于水
C. HCl易溶于水 D. NH3易溶于苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取部分物质的过程如下图所示,下列有关说法错误的是
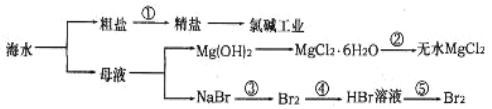
A.过程①需要加入化学试剂、沉淀、过滤等操作
B.由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C.工业上一般用电解氯化镁溶液制取Mg单质
D.反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。
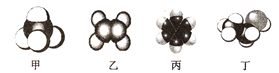
(1)可以鉴别甲和乙的试剂为__________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(2)上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是______(填名称),将其加入溴水中,振荡后静置,观察到的现象是______。
(3)以乙为主要原料合成乙酸,合成路线如图所示:(已知2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
![]()
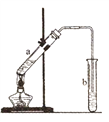
①丁生成A的化学方程式为_______________;
②如图,丁与乙酸在浓硫酸作用下发生反应,当观察到b试管中有明显现象时,停止实验。生成的有机物的结构简式为___________;试管b中的溶液是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乳酸的结构简式为: 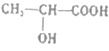 .
.
(1)乳酸分子中含有和两种官能团(填官能团名称).90g乳酸与足量金属钠反应产生的气体在标准状况下的体积是L.方程式为 . 已知两分子乳酸可在一定条件下反应生成环状的酯,写出该反应的方程式 .
(2)已知葡萄糖可以和醋酸在一定条件下发生酯化反应,则1摩尔葡萄糖最多可以消耗摩尔醋酸.
(3)分子式为C6H12的某烃,其所有的碳原子都一定在同一平面上,则该烃的结构简式为 .
(4)某苯的同系物分子式为C11H16 , 苯环上只有一个取代基,其同分异构体共有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com