
| A. | 加入Al能放出大量H2的溶液中:Na+、HCO3-、NO3-、Cl-、SO42- | |
| B. | 在pH=11的溶液中:Na+、AlO2-、NO3-、SO32- | |
| C. | 常温时,由水电离的c(H+)=10-12mol•L-1的溶液中:Cl-、Fe2+、NO3-、NH4+、F- | |
| D. | 加入Mg能放出H2的溶液中:NH4+、Cl-、K+、Cu2+ |
分析 A.加入Al能放出大量H2的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子、氢氧根离子反应;
B.pH=11的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.常温时,由水电离的c(H+)=10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,亚铁离子、铵根离子与氢氧根离子反应,酸性条件下硝酸根离子能够氧化亚铁离子,氟离子与氢离子反应;
D.加入Mg能放出H2的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应.
解答 解:A.加入Al能放出大量H2的溶液呈酸性或强碱性,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故A选;
B.在pH=11的溶液呈碱性,溶液中存在大量氢氧根离子,Na+、AlO2-、NO3-、SO32-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B不选;
C.常温时,由水电离的c(H+)=10-12mol•L-1的溶液呈酸性或碱性,Fe2+、NH4+与碱性溶液中的氢氧根离子反应,Fe2+、NO3-在酸性条件下发生氧化还原反应,F-与酸性溶液中的氢离子反应,在溶液中一定不能大量共存,故C选;
D.加入Mg能放出H2的溶液呈酸性,溶液中存在大量氢离子,NH4+、Cl-、K+、Cu2+之间不反应,都不与氢离子反应,在溶液中能够大量共存,故D不选;
故选AC.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 该物质的名称为 2,2,3-三甲基-3-丁烯 | |
| B. | 分子中最多 4 个碳原子共平面 | |
| C. | 此物质转化为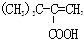 的过程中需依次经过加成、取代、氧化、消去反应 的过程中需依次经过加成、取代、氧化、消去反应 | |
| D. | 此物质与氢气加成后的产物与此物质中氢原子的种类数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
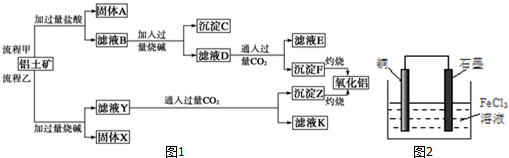
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙苯 ②
乙苯 ② 2-丙醇
2-丙醇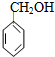 苯甲醇 ④
苯甲醇 ④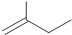 2-甲基-1-丁烯
2-甲基-1-丁烯 ③二乙酸乙二酯
③二乙酸乙二酯 ④甘氨酸H2NCH2COOH.
④甘氨酸H2NCH2COOH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
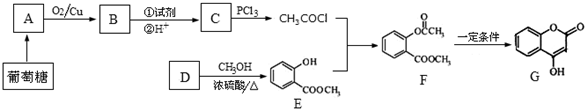
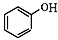 +NaOH→
+NaOH→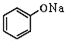 +H2O
+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12升 | B. | 2,24升 | C. | 2.94升 | D. | 5.88升 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
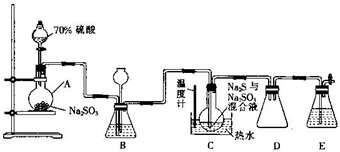 Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.
Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com