

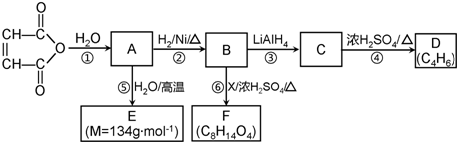

 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O. 分析  与水反应生成A,由反应信息可知,A为HOOCCH=CHCOOH,A与水在高温反应生成E,E的相对分子质量为134,比A的相对分子质量大134-116=18,故A与水发生加成反应生成E,则E的结构简式为
与水反应生成A,由反应信息可知,A为HOOCCH=CHCOOH,A与水在高温反应生成E,E的相对分子质量为134,比A的相对分子质量大134-116=18,故A与水发生加成反应生成E,则E的结构简式为 ;A与氢气发生加成反应生成B,则B为HOOCCH2CH2COOH,B与X在浓硫酸、加热条件下生成F,F的分子式为C8H14O4,应是发生酯化反应,F的核磁共振氢谱有3个峰,峰面积之比为2:2:3,相应H原子数目为4、4、6,故X为CH3CH2OH,F为CH3CH2OOCCH2CH2COOCH2CH3;B在LiAlH4作用下发生信息中的反应生成C,则C为HOCH2CH2CH2CH2OH,C转化为D,D的分子式为C4H6,应是发生消去反应生成D,则D为CH2=CHCH=CH2,据此解答.
;A与氢气发生加成反应生成B,则B为HOOCCH2CH2COOH,B与X在浓硫酸、加热条件下生成F,F的分子式为C8H14O4,应是发生酯化反应,F的核磁共振氢谱有3个峰,峰面积之比为2:2:3,相应H原子数目为4、4、6,故X为CH3CH2OH,F为CH3CH2OOCCH2CH2COOCH2CH3;B在LiAlH4作用下发生信息中的反应生成C,则C为HOCH2CH2CH2CH2OH,C转化为D,D的分子式为C4H6,应是发生消去反应生成D,则D为CH2=CHCH=CH2,据此解答.
解答 解: 与水反应生成A,由反应信息可知,A为HOOCCH=CHCOOH,A与水在高温反应生成E,E的相对分子质量为134,比A的相对分子质量大134-116=18,故A与水发生加成反应生成E,则E的结构简式为
与水反应生成A,由反应信息可知,A为HOOCCH=CHCOOH,A与水在高温反应生成E,E的相对分子质量为134,比A的相对分子质量大134-116=18,故A与水发生加成反应生成E,则E的结构简式为 ;A与氢气发生加成反应生成B,则B为HOOCCH2CH2COOH,B与X在浓硫酸、加热条件下生成F,F的分子式为C8H14O4,应是发生酯化反应,F的核磁共振氢谱有3个峰,峰面积之比为2:2:3,相应H原子数目为4、4、6,故X为CH3CH2OH,F为CH3CH2OOCCH2CH2COOCH2CH3;B在LiAlH4作用下发生信息中的反应生成C,则C为HOCH2CH2CH2CH2OH,C转化为D,D的分子式为C4H6,应是发生消去反应生成D,则D为CH2=CHCH=CH2;
;A与氢气发生加成反应生成B,则B为HOOCCH2CH2COOH,B与X在浓硫酸、加热条件下生成F,F的分子式为C8H14O4,应是发生酯化反应,F的核磁共振氢谱有3个峰,峰面积之比为2:2:3,相应H原子数目为4、4、6,故X为CH3CH2OH,F为CH3CH2OOCCH2CH2COOCH2CH3;B在LiAlH4作用下发生信息中的反应生成C,则C为HOCH2CH2CH2CH2OH,C转化为D,D的分子式为C4H6,应是发生消去反应生成D,则D为CH2=CHCH=CH2;
(1)B为HOOCCH2CH2COOH,含有羧基,反应④为HOCH2CH2CH2CH2OH发生消去反应生成CH2=CHCH=CH2,
故答案为:羧基;消去反应;
(2)由上述分析可知,E为 ,故答案为:
,故答案为: ;
;
(3)D为CH2=CHCH=CH2,与足量溴发生加成反应所得产物为BrCH2CHBrCHBrCH2Br,名称为:1,2,3,4-四溴丁烷,故答案为:1,2,3,4-四溴丁烷;
(4)反应⑥是HOOCCH2CH2COOH与CH3CH2OH发生酯化反应生成CH3CH2OOCCH2CH2COOCH2CH3,反应方程式为HOOCCH2CH2COOH+2C2H5OH  C2H5OOCCH2CH2COOC2H5+2H2O,
C2H5OOCCH2CH2COOC2H5+2H2O,
故答案为:HOOCCH2CH2COOH+2C2H5OH  C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O.
点评 本题考查有机物的推断,注意根据反应信息结合反应条件与转化关系中分子式、相对分子质量进行推断,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力,难度中等.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水的pH随着温度的升高而降低 | B. | 在35℃时,[H+]>[OH-] | ||
| C. | 在25℃和35℃时,[H+]=[OH-] | D. | 水的电离是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-+CO32-+2H+→HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+2H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+. ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )| A. | T℃时,该反应的平衡常数值为4 | |
| B. | c点没有达到平衡,此时反应向逆向进行 | |
| C. | 若c点为平衡点,则此时容器内的温度高于T℃ | |
| D. | T℃时,在d点加入一定量X可达到c点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com