
【题目】下列关于实验室制取气体所用试剂的组合中不合理的是( )
A.制Cl2:MnO2、浓盐酸
B.制NH3:浓氨水、生石灰
C.制NO:稀硝酸、Cu
D.制CO2:稀硫酸、CaCO3
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行试验.A,B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO ![]() 从右向左移动.下列说法错误的是( )
从右向左移动.下列说法错误的是( ) 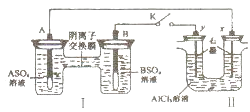
A.电解一段时间后,向Ⅱ装置通入适量的HCl气体可以恢复原来的浓度
B.反应初期,y电极周围出现白色沉淀
C.B电极质量增加
D.x电极产生气泡,且生成1mol气体的同时,有1molA参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( ) 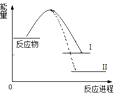
A.1molN≡N键能与3molH﹣H键能之和大于6molN﹣H键能,所以反应为放热
B.N2(g)+3H2(g)2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)(摩/升分)表示,则正确的关系是( )
A.![]() ν(NH3)=ν(O2)
ν(NH3)=ν(O2)
B.![]() ν(O2)=ν(H2O)
ν(O2)=ν(H2O)
C.![]() ν(NH3)=ν(H2O)
ν(NH3)=ν(H2O)
D.![]() ν(O2)=ν(NO)
ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 金属氧化物都能和水反应
B. Fe(OH)3 胶体带正电
C. 往 Fe(OH)3 胶体中逐滴滴入硫酸溶液,现象是:先有红褐色沉淀后沉淀溶解
D. Fe(OH)3 胶体能够吸附水中悬浮的固体颗粒沉降,达到消毒目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO45H2O是铜的重要化合物,有着广泛的应用.
(1)CuSO45H2O制取
完成下列填空:
a.向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),铜粉溶解时可以观察到的实验现象: .
b.根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为 .
c.步骤Ⅰ;步骤Ⅱ .
(2)胆矾中CuSO45H2O含量的测定
已知:CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
a.实验方案如下,并将步骤④补全:
①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应);
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸;
④
⑤数据处理.
b.在滴定中,眼睛应注视;滴定终点时,准确读数应该是滴定管上所对应的刻度.
c.就方案中数据进行处理,则样品CuSO45H2O中质量分数为 . 步骤③中沉淀未洗涤,导致结果(填偏大、偏小、无影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 6.02×1023是阿伏加德罗常数的近似值
B. 阿伏加德常数个微粒的物质的量是1mol
C. 1mol12C原子的质量为12g
D. 硫酸的摩尔质量是98克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】限用硫酸、盐酸、醋酸、钠盐、钾盐在溶液中反应,符合离子方程式2H++CO32-===H2O+CO2↑的化学方程式的个数有( )
A. 3B. 5C. 8D. 12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com