
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。
(1)实验室在40℃、pH﹦4的条件下用Na2SO3溶液和SO2反应制取Na2S2O5:Na2SO3+SO2=Na2S2O5实验时先用CO2气体尽可能排除装置内空气的目的是_____________。
(2)若制备19 g Na2S2O5至少需标准状况下SO2_____________L。
(3)为了检验某抗氧化剂产品中Na2S2O5的质量分数,某研究小组进行如下实验:
步骤I:称取抗氧化剂产品0.2 g,将其加入到含I2浓度为0.05000 mol·L1 的100 mL稀盐酸和碘水的混合溶液中,然后加水稀释至500 mL。
步骤II:取稀释后的溶液100 mL,加入几滴淀粉溶液,用0.1000 mol·L1 Na2S2O3标准溶液进行滴定,共消耗Na2S2O3标准溶液12.00 mL(2S2O32- + I2=2I- + S4O62-)。
①写出步骤I中Na2S2O5和I2反应的离子方程式_____________。
②计算抗氧化剂产品中Na2S2O5质量分数,写出计算过程_____________。
【答案】 防止焦亚硫酸钠被氧化 2.24 S2O52- + 2I2 + 3H2O=2SO42-+ 4I- + 6H+ 在500 mL混合溶液中溶解I2的物质的量为:
n(I2) = 0.05000 mol·L1×100 mL×10-3 L·ml1=5.00×10-3 mol
Na2S2O3标准溶液消耗I2物质的量为
2S2O32-+I2=2I-+S4O62-
n(I2) =![]() =6.00×0-4 mol
=6.00×0-4 mol
则在500mL混合溶液中与反应消耗I2物质的量为
n(I2) =5.00×10-3 mol﹣6.00×10-4 mol ×5 =2.00×0-3 mol
n(Na2S2O5) =![]() =1.00×10-3 mol
=1.00×10-3 mol
Na2S2O5的质量分数=![]() ×100%=95%
×100%=95%
【解析】试题分析:(1)Na2S2O5易被氧气氧化。
(2)根据化学方程式计算制备19 g Na2S2O5至少需标准状况下SO2的体积。(3)①Na2S2O5被I2氧化为硫酸钠;
②Na2S2O5和Na2S2O3都与碘单质反应,根据方程式计算抗氧化剂产品中Na2S2O5质量分数。
解析:(1). Na2S2O5易被氧气氧化,为防止焦亚硫酸钠被氧化,先用CO2气体尽可能排除装置内空气 ;
(2)设制备19 g Na2S2O5需标准状况下SO2的体积为VL;
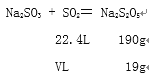
![]() ,V=2.24L
,V=2.24L
(3)①Na2S2O5被I2氧化成硫酸钠,根据电子守恒配平方程式,S2O52- + 2I2 + 3H2O=2SO42-+ 4I- + 6H+ 。
(4). 在500 mL混合溶液中溶解I2的物质的量为:
n(I2) = 0.05000 mol·L1×100 mL×10-3 L·ml1=5.00×10-3 mol
Na2S2O3标准溶液消耗I2物质的量为
2S2O32-+I2=2I-+S4O62-
n(I2) =![]() =6.00×0-4 mol
=6.00×0-4 mol
则在500mL混合溶液中与反应消耗I2物质的量为
n(I2) =5.00×10-3 mol﹣6.00×10-4 mol ×5 =2.00×0-3 mol
n(Na2S2O5) =![]() =1.00×10-3 mol
=1.00×10-3 mol
Na2S2O5的质量分数=![]() ×100%=95%
×100%=95%


科目:高中化学 来源: 题型:
【题目】葡萄糖在不同条件下可以被氧化成不同物质。请结合题意回答问题:已知:RCOOH+CH2===CH2+![]() O2
O2![]() RCOOCH===CH2+H2O
RCOOCH===CH2+H2O
(1)葡萄糖在酒化酶作用下生成有机物A,A、B、C、D、E间的转化关系如下图所示:

①B是石油化学工业最重要的基础原料,写出A→B的化学方程式:___________________________________________。
②D的结构简式为_____________________________。
(2)葡萄糖在一定条件下还可氧化为X和Y(Y和A的相对分子质量相同)。X可催化氧化成Y,也可与H2反应生成Z。X和Y的结构中有一种相同的官能团是________,检验此官能团需用的试剂是________。
(3)F是人体肌肉细胞中的葡萄糖在缺氧的条件下进行无氧呼吸的产物。F、G、H间的转化关系是:F![]() G
G![]() H,H与(1)中的D互为同分异构体。
H,H与(1)中的D互为同分异构体。
①G还可以发生的反应有________(填字母)
a.加成反应 b.水解反应 c.氧化反应 d.消去反应 e.还原反应
②本题涉及的所有有机物中,与F不论以何种质量比混合(总质量一定),完全燃烧生成CO2和H2O的物质的量不变的有(写结构简式)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,向20 mL 0.1 mol·L-1的Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸(忽略H2CO3的分解和CO2的挥发),溶液pH随盐酸加入的体积变化曲线如图。下列说法正确的是

A. 点①所示溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B. 点②所示溶液中:c(CO32-)>c(Cl-)>c(HCO3-)>c(OH-)
C. 点③所示溶液中:c(OH-)﹣c(H+)=c(H2CO3)﹣c(CO32-)
D. 点④所示溶液中:c(Cl-)=2c(H2CO3) + c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统医学治疗疟疾时将青蒿加水煮沸,但药效很差。改用乙醇控温60℃提取青蒿素,药效显著提高。屠呦呦用一种更适宜的物质从青蒿中提取青蒿素,这种提取物对疟原虫的抑制率达到了100%,这种适宜的物质是
A | B | C | D | |
物质 | 乙醚 | 四氯化碳 | 丙醇 | 煤油 |
沸点℃ | 34.5 | 76.5 | 97.4 | 180-310 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)有6.02×l023个H的H2O,其物质的量是_______;1molNa2SO4中所含的离子总数目为______。
(2)_____molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为_______。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为________。
(5)标准状况下,密度为0.75g·L-1的NH3与CH4组成的混合气体中,该混合气体对氢气的相对密度为____________。
(6)已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组用下图所示的实验装置,利用氢氧化钠固体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理:2NH3(g) + CO2(g)=H2NCOONH4(s) ΔH<0。

(1)仪器2的名称是_____________。仪器3中NaOH固体的作用是_____________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该_____________(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(3)另有一种制备氨基甲酸铵的反应器(CCl4充当惰性介质)如下图:

①若无冰水,则氨基甲酸铵易分解生成尿素[化学式为CO(NH2)2]。请写出氨基甲酸铵受热分解的化学反应方程式:_____________。
②当CCl4液体中产生较多晶体悬浮物时,即停止反 应,过滤分离得到粗产品,为了将所得粗产品干燥可采取的方法是_____________。
A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式为_____________。
为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验。已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案:用天平称取一定质量的样品,加水溶解,_____________,测量的数据取平均值进行计算(限选试剂:蒸馏水、澄清石灰水、BaCl2溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是
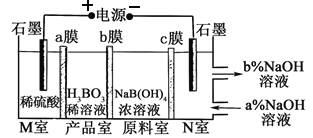
A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴离子交换膜
D. 理论上每生成1mol产品,阴极室可生成5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光的装置如图。下列说法错误的是( )
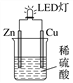
A. 铜片表面有气泡生成,锌片上发生氧化反应
B. 如果将稀硫酸换成葡萄糖溶液,不能使LED灯发光
C. 装置中存在“化学能→电能→光能”的转换
D. 如果将铜片换成铁片,则锌片为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com