
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________、_________________。
②试剂B是__________。
③ 操作③是_____________、_____________、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________mol。
【答案】0.01 Fe +2Fe3+ = 3Fe2+ Fe +2H+ = Fe2+ +H2↑ 硫酸 蒸发浓缩 冷却结晶 取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽 FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水) 生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色 12
【解析】
(1)水溶液中,溶液呈电中性,即溶液中阴阳离子所带的电荷总数为零,在同一溶液中体积相等,2×10-3×3+1×10-3×2+2×10-3×1+c(H+)=1×10-2×2,则c(H+)=0.01mol/L;
(2)①向废水中加入铁粉后,首先三价铁离子与铁反应,然后为Fe + Cu2+ == Fe2+ + Cu 、最后为Fe +2H+ = Fe2+ +H2↑,答案为:Fe +2Fe3+ = 3Fe2+;Fe +2H+ = Fe2+ +H2↑;
②固体C为Fe、Cu的混合物,经过操作②过滤分离固体和液体,滤液回收,则试剂B为可溶解Fe,为酸,且阴离子为硫酸根离子,试剂B为硫酸;
③ 硫酸亚铁溶液经过操作③可得到硫酸亚铁晶体,则加热温度不能太高,可采用加热浓缩、冷却结晶、过滤的方法得到硫酸亚铁晶体;
④若溶液中含有Fe3+,加入硫氰化钾溶液后,显血红色,故答案为取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽;
⑤硫酸亚铁晶体中的亚铁离子不稳定,有还原性容易被空气中的氧气氧化变质,同时也很容易失去结晶水,亚铁离子与碱反应生成氢氧化亚铁,白色沉淀,被空气中的氧气氧化,迅速变为灰绿色,最终变为红褐色,答案为:FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水);生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色;
⑥1000l废水中含有Fe3+ 为 2mol,铁粉为10mol且过量,过量的在操作②中全部变为Fe2+,则溶液中的Fe2+ 的物质的量共计12mol,可获得 FeSO4·7H2O的物质的量是12mol。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
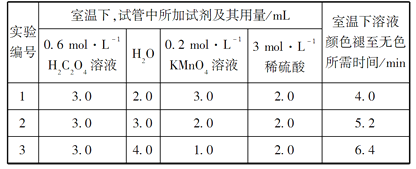
请回答:
(1)以上反应的化学方程式:__________________。
(2)根据上表中的实验数据,可以得到的结论是:_____________。
(3)利用实验1中数据计算,用KMnO4的浓度变化表示反应速率v(KMnO4)=_____。

(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应,下列叙述中不正确的是 ( )
①放热的反应发生时不必加热 ②化学反应一定有能量变化 ③吸热反应需要加热后才能发生 ④化学反应热效应数值与参加反应的物质的量多少有关。
A. ②④B. ②③C. ①③D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
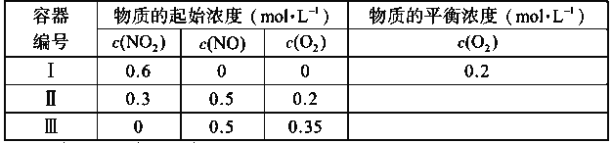
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中NO的体积分数小于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂海水电池的反应原理为:2Li+2H2O=2LiOH+H2↑,其示意图如图所示。有关该电池工作时说法错误的是

A.金属锂作正极
B.镍电极上发生还原反应
C.海水作为电解质溶液
D.可将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
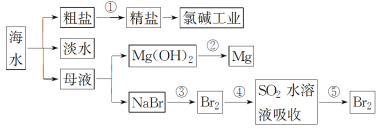
(1)过程①是为了除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,若要除去SO42-,则需要加入的试剂为_____________;若所加的该试剂过量,则可以被后加入的________________除去。
(2)过程②能否一步实现转化?______________(填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为_____________________________________________。
(3)过程④反应的离子方程式为_____________________________________________________。
(4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的_____________放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
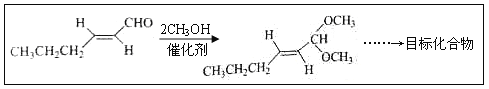
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
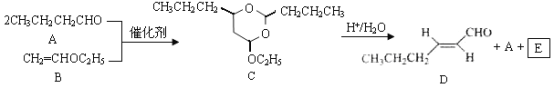
已知: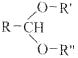
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____________,△H____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_____________。
A(g)+B(g)的平衡常数的值为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com