
【题目】Cu2+能与NH3、H2O、C1-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有____(填序号)。
A.配位链 B.极性共价键 C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________________________________。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2![]() CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
【答案】 A,B 平面四边形 sp2
【解析】(1). [Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,NH为极性共价键,故答案为:AB;
(2). [Cu(NH3)4]2+中有4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,若为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl取代,只有一种结构,所以应为平面正方形,故答案为:平面正方形;
(3).丙烯醇中构成C=C的两个碳原子是sp2杂化,另一个C为sp3杂化,丙醛分子中C=O中的C采取sp2杂化,另外2个C为sp3杂化,在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为sp2杂化,故答案为:sp2杂化。


科目:高中化学 来源: 题型:
【题目】下列溶液中,能大量共存的离子组是
A.K+、Na+、CO32-、NO3-B.Ag+、Na+、SO42-、Cl-
C.OH-、HCO3-、Ca2+、Na+D.Ba2+、Na+、OH-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关正硼酸的说法正确的是 ( )
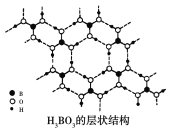
A.1 mol H3BO3晶体中含有6 mol氢键
B.硼原子、氧原子最外层均为8电子的稳定结构
C.H3BO3分子中既存在σ键,又存在π键
D.H3BO3分子的稳定性与氢键无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是

A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) < c(CH3COOH)
C. c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-)
D. d点水的电离程度大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(多选)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是(____)
A.SiX4难水解 B.SiX4是共价化合物
C.NaX易水解 D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
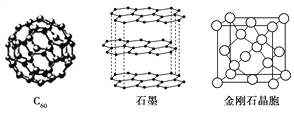
回答下列问题:
(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________a,列式表示碳原子在晶胞中的空间占有率________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀士氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:

已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
(1)焙烧过程中发生的主要反应方程式为____________________________________。
(2)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。
Ce·(H2n-4A2n)+4H+。
①实验室中萃取时用到的主要玻璃仪器为烧杯和__________________。
②右图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
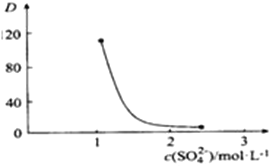
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)=_________。 (结果保留三位有效数字)
(3) “反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作用与下列反应中H2O2的作用相同的是____________。
A. H2O2和MnO2混合制O2 B.用H2O2处理含酸性K2Cr2O7的废水
C.H2O2和CaO混合制备CaO2 D.用稀硫酸和H2O2的混合液溶解金属Cu
(4)溶液中c(Ce3+)等于1.0×10-5mol·L-1,可认为Ce3+沉淀完全,此时溶液的pH为______________,
(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 _____________________________________ 。
(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为______ %;下列选项可能使测定结果偏低的是__________。
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为54,对应原子最外层电子数之和为20。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,该反应的离子方程式为______________________________________________________。
(2)X与W可形成X2W和X2W2两种化合物,X2W2的电子式为_____________。
(3)Q与W可形成化合物QW2,这种化合物固态时属于________晶体。
(4)Y的硝酸盐水溶液显________性,用离子方程式解释原因___________________。
(5)Z的氢化物与W的氢化物发生反应生成Z的单质和水,其化学方程式为_____________________。
(6)W、X、Y、Z四种元素原子半径由大到小的顺序是:________(用元素符号表示)。
(7)0.5 mol Q的单质与足量的W单质完全反应,放出196.75 kJ的热量。写出该反应的热化学方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
B. 钠与水的反应:Na+2H2O=Na++2OH-+H2↑
C. 铜片跟稀硝酸的反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
D. 将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com