
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为54,对应原子最外层电子数之和为20。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,该反应的离子方程式为______________________________________________________。
(2)X与W可形成X2W和X2W2两种化合物,X2W2的电子式为_____________。
(3)Q与W可形成化合物QW2,这种化合物固态时属于________晶体。
(4)Y的硝酸盐水溶液显________性,用离子方程式解释原因___________________。
(5)Z的氢化物与W的氢化物发生反应生成Z的单质和水,其化学方程式为_____________________。
(6)W、X、Y、Z四种元素原子半径由大到小的顺序是:________(用元素符号表示)。
(7)0.5 mol Q的单质与足量的W单质完全反应,放出196.75 kJ的热量。写出该反应的热化学方程式:____________________________________________。
【答案】 )Al(OH)3+OH-===AlO2-+2H2O Na+[··![]() ··
··![]() ··]2-Na+ 分子 酸 Al3++3H2O
··]2-Na+ 分子 酸 Al3++3H2O![]() Al(OH)3+3H+ H2S+H2O2===S↓+2H2O Na>Al>S>O C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Al(OH)3+3H+ H2S+H2O2===S↓+2H2O Na>Al>S>O C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
【解析】W、Z最外层电子数相同,但是Z的核电荷数是W的2倍,短周期元素中只有O、 S符合;X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,因为Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,所以X是钠、Y是铝;根据五种元素核电荷数之和为54,对应原子最外层电子数之和为20,得出Q为碳元素。
(1)氢氧化钠溶液与氢氧化铝反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-===AlO2-+2H2O;正确答案:Al(OH)3+OH-===AlO2-+2H2O。
(2) 钠与氧形成氧化钠和过氧化钠两种氧化物,过氧化钠的电子式为![]() ;正确答案:
;正确答案:![]() 。
。
(3)二氧化碳固态时为分子晶体;正确答案:分子晶体。
(4)硝酸铝为强酸弱碱盐,水解显酸性,离子方程式为Al3++3H2O![]() Al(OH)3+3H+;正确答案:酸性;Al3++3H2O
Al(OH)3+3H+;正确答案:酸性;Al3++3H2O![]() Al(OH)3+3H+。
Al(OH)3+3H+。
(5)硫化氢与双氧水发生氧化还原反应生成单质硫和水,其化学方程式为H2S+H2O2===S↓+2H2O ;正确答案:H2S+H2O2===S↓+2H2O。
(6) Na、 Al、S三种元素位于同一周期,随着原子序数的递增,原子半径逐渐减小,所以
原子半径大小为Na>Al>S;O与S为同一主族,从上到下,原子半径逐渐增大,O<S;原子半径由大到小的顺序是Na>Al>S>O;正确答案:Na>Al>S>O。
(7) 0.5 molC与足量的O2完全反应生成CO2气体,放出196.75 kJ的热量;反应的热化学方程式:1/2C(s)+1/2O2(g)===1/2CO2(g) ΔH=-196.75kJ·mol-1或C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;正确答案:1/2C(s)+1/2O2(g)===1/2CO2(g) ΔH=-196.75kJ·mol-1或C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是( )
A.3:2
B.2:1
C.1:1
D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、C1-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有____(填序号)。
A.配位链 B.极性共价键 C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________________________________。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2![]() CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q为短周期非金属元素,R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+只有三个电子层且完全充满电子。请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2)X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
![]()
①该分子中两个Y原子之间的键型组合正确的是 。
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是 。
(4)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:R(OH)3+2ClO﹣+4OH﹣═RO4n﹣+3Cl﹣+5H2O.则RO4n﹣ 中R的化合价是( )
A.+7
B.+6
C.+5
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验是化学中的基础实验,请回答有关问题。
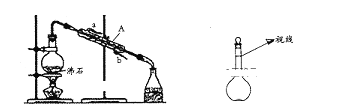
(1)用四氯化碳提取溴水中的溴,所用的分离方法是______,用到的主要仪器是______________,
(2)用图装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有_____,实验时仪器A中冷却水的进口为_______________(选填“a”或“b)
(3)实验室需配制100mL 3.6mol·L—1的稀硫酸。若采用18 mol·L—1的浓硫酸来配制稀硫酸需要用到浓硫酸的体积为_____________,实验中将溶液转移到容量瓶中的正确操作是_________________________。在稀硫酸配制过程中,某同学观察液面的情况如图所示,所配稀硫酸的浓度会____________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素原子的核外电子排布决定了元素在元素周期表中的位置,已知某元素原子的核外电子排布式为1s22s22p63s23p63d34s2。该元素位于元素周期表
A. 第4周期第ⅤB族 B. 第4周期第ⅡA族
C. 第2周期第ⅡB族 D. 第5周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗;②容量瓶;③温度计;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com