
【题目】X、Y、Z、Q为短周期非金属元素,R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+只有三个电子层且完全充满电子。请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2)X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
![]()
①该分子中两个Y原子之间的键型组合正确的是 。
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是 。
(4)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键
【答案】(1)1s22s22p63s23p63d104s1(或[Ar]3d104s1)
(2)N>O>C (3)①C ②sp2 (4)B、C、D
【解析】由题意可知X为碳元素,Y为氮元素,Z为氧元素,Q为氟元素,R为铜元素。
(1)Cu为29号元素,电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
(2)C、N、O三种元素的第一电离能由大到小的顺序为N>O>C。
(3)由N2F2的两种结构可知,其结构式为
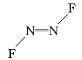 和
和![]()
两个N原子以双键形式成键,存在1个σ键和1个π键,C项正确;N原子采取sp2杂化。
(4)观察图形可发现与C原子相连的有4个N原子,与N原子相连的有3个C原子,形成了空间立体网状结构。可知该晶体为原子晶体,化学式为C3N4,晶体熔化时,化学键被破坏,故A项错误,C、D两项正确。对原子晶体而言,键长越短,其硬度越大,由于C—C键的键长大于C—N键的键长,故该晶体的硬度比金刚石还大,B项正确。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):

(1)若A是一种金属,C是淡黄色固体,则B的化学式为________,A→C反应的化学方程式为___________________,C与H2O反应的化学方程式____________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为________,B→C反应的化学方程式为_____________________。A和C能否反应?________(填“能”或“不能”),若能,写出反应的化学方程式: _________________________(若不能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关正硼酸的说法正确的是 ( )
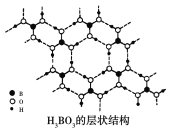
A.1 mol H3BO3晶体中含有6 mol氢键
B.硼原子、氧原子最外层均为8电子的稳定结构
C.H3BO3分子中既存在σ键,又存在π键
D.H3BO3分子的稳定性与氢键无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(多选)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是(____)
A.SiX4难水解 B.SiX4是共价化合物
C.NaX易水解 D.NaX的熔点一般高于SiX4
Ⅱ.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
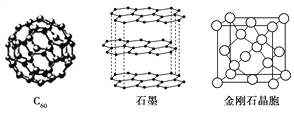
回答下列问题:
(1)金刚石、石墨、C60和碳纳米管等都是碳元素的单质形式,它们互为________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________、________。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C—C间的________共价键,而石墨层内的C—C间不仅存在________共价键,还有________键。
(5)金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________a,列式表示碳原子在晶胞中的空间占有率________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀士氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:

已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
(1)焙烧过程中发生的主要反应方程式为____________________________________。
(2)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。
Ce·(H2n-4A2n)+4H+。
①实验室中萃取时用到的主要玻璃仪器为烧杯和__________________。
②右图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
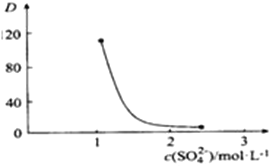
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)=_________。 (结果保留三位有效数字)
(3) “反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作用与下列反应中H2O2的作用相同的是____________。
A. H2O2和MnO2混合制O2 B.用H2O2处理含酸性K2Cr2O7的废水
C.H2O2和CaO混合制备CaO2 D.用稀硫酸和H2O2的混合液溶解金属Cu
(4)溶液中c(Ce3+)等于1.0×10-5mol·L-1,可认为Ce3+沉淀完全,此时溶液的pH为______________,
(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 _____________________________________ 。
(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为______ %;下列选项可能使测定结果偏低的是__________。
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
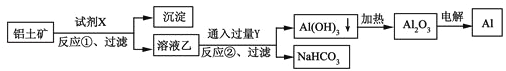
A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为54,对应原子最外层电子数之和为20。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,该反应的离子方程式为______________________________________________________。
(2)X与W可形成X2W和X2W2两种化合物,X2W2的电子式为_____________。
(3)Q与W可形成化合物QW2,这种化合物固态时属于________晶体。
(4)Y的硝酸盐水溶液显________性,用离子方程式解释原因___________________。
(5)Z的氢化物与W的氢化物发生反应生成Z的单质和水,其化学方程式为_____________________。
(6)W、X、Y、Z四种元素原子半径由大到小的顺序是:________(用元素符号表示)。
(7)0.5 mol Q的单质与足量的W单质完全反应,放出196.75 kJ的热量。写出该反应的热化学方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______(填化学式),呈现如此递变规律的原因是________________________________。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___,另一种的晶胞如图二所示,该晶胞的空间利用率为________________(保留两位有效数字)。(![]() )
)
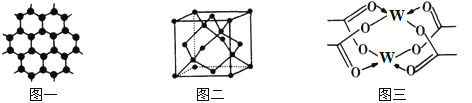
(4)W元素形成的单质,其晶体的堆积模型为___________,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________。请写出上述过程的离子方程式___________________________ ,___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
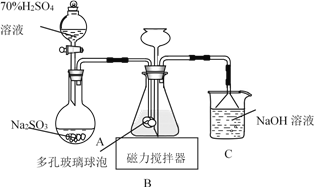
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com