
【题目】原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______(填化学式),呈现如此递变规律的原因是________________________________。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___,另一种的晶胞如图二所示,该晶胞的空间利用率为________________(保留两位有效数字)。(![]() )
)
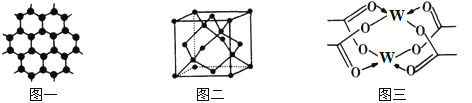
(4)W元素形成的单质,其晶体的堆积模型为___________,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________。请写出上述过程的离子方程式___________________________ ,___________________________________。
【答案】 ![]() HF>HI>HBr>HCl HF分子之间形成氢键,使其沸点较高,HCl、HBr、HI,分子间以分子间作用力结合,相对分子质量越大,范德华力越大,沸点越高 sp2 34% 面心立方最密堆积 ①②③ 先生成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色透明溶液 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-
HF>HI>HBr>HCl HF分子之间形成氢键,使其沸点较高,HCl、HBr、HI,分子间以分子间作用力结合,相对分子质量越大,范德华力越大,沸点越高 sp2 34% 面心立方最密堆积 ①②③ 先生成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色透明溶液 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-
【解析】试题分析:根据题意可知A是H;B是C;C是Cl;D是Cu。(1)这四种元素中电负性最大的元素是Cl,其基态原子的价电子排布图为![]() ;(2)C所在主族的前四种元素分别是F、Cl、Br、I它们与H形成的化合物是 HF、HCl、HBr、HI,同族元素形成的氢化物结构相似,都是由分子构成的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,而HF分子之间除了存在着一般的分子间作用力外,还存在着氢键,增加了分子之间的吸引力,使其熔沸点比HI还高。故这几种氢化物的沸点由高到低的顺序是HF>HI>HBr>HCl;呈现如此递变规律的原因是HF分子之间形成氢键,使共沸点较高,HCl、HBr、HI,分子量越大,范德华力越大,沸点越高。(3)B元素可形成多种单质,一种晶体结构如图一所示,该晶体是石墨晶体,由于每一个碳原子形成了2个碳碳单键和1个碳碳双键,所以其原子的杂化类型为sp2杂化;在一个晶胞中含有的该元素的原子个数是8×1+6×1/2+4=8,假设晶胞的边长为L,原子的半径为r,则该晶胞中晶胞边长与原子半径的关系是
;(2)C所在主族的前四种元素分别是F、Cl、Br、I它们与H形成的化合物是 HF、HCl、HBr、HI,同族元素形成的氢化物结构相似,都是由分子构成的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高,而HF分子之间除了存在着一般的分子间作用力外,还存在着氢键,增加了分子之间的吸引力,使其熔沸点比HI还高。故这几种氢化物的沸点由高到低的顺序是HF>HI>HBr>HCl;呈现如此递变规律的原因是HF分子之间形成氢键,使共沸点较高,HCl、HBr、HI,分子量越大,范德华力越大,沸点越高。(3)B元素可形成多种单质,一种晶体结构如图一所示,该晶体是石墨晶体,由于每一个碳原子形成了2个碳碳单键和1个碳碳双键,所以其原子的杂化类型为sp2杂化;在一个晶胞中含有的该元素的原子个数是8×1+6×1/2+4=8,假设晶胞的边长为L,原子的半径为r,则该晶胞中晶胞边长与原子半径的关系是![]() ,则
,则![]() ,所以该晶胞的空间利用率为
,所以该晶胞的空间利用率为 ;(4)Cu元素形成的单质,其晶体的堆积模型为面心立方最密堆积;根据Cu的醋酸盐晶体局部结构图示可知该晶体中含有的化学键是极性键、非极性键、配位键,因此选项是①②③。(5)向CuSO4溶液中滴加过量氨水,首先发生反应Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,看到溶液产生蓝色沉淀,后发生反应: Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-,沉淀溶解,变为蓝色溶液;
;(4)Cu元素形成的单质,其晶体的堆积模型为面心立方最密堆积;根据Cu的醋酸盐晶体局部结构图示可知该晶体中含有的化学键是极性键、非极性键、配位键,因此选项是①②③。(5)向CuSO4溶液中滴加过量氨水,首先发生反应Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,看到溶液产生蓝色沉淀,后发生反应: Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-,沉淀溶解,变为蓝色溶液;


科目:高中化学 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )
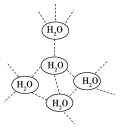
A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q为短周期非金属元素,R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+只有三个电子层且完全充满电子。请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为 。
(2)X、Y、Z三种元素第一电离能从大到小顺序为 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
![]()
①该分子中两个Y原子之间的键型组合正确的是 。
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是 。
(4)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验是化学中的基础实验,请回答有关问题。
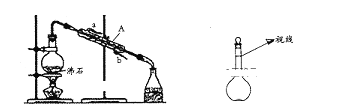
(1)用四氯化碳提取溴水中的溴,所用的分离方法是______,用到的主要仪器是______________,
(2)用图装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有_____,实验时仪器A中冷却水的进口为_______________(选填“a”或“b)
(3)实验室需配制100mL 3.6mol·L—1的稀硫酸。若采用18 mol·L—1的浓硫酸来配制稀硫酸需要用到浓硫酸的体积为_____________,实验中将溶液转移到容量瓶中的正确操作是_________________________。在稀硫酸配制过程中,某同学观察液面的情况如图所示,所配稀硫酸的浓度会____________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素原子的核外电子排布决定了元素在元素周期表中的位置,已知某元素原子的核外电子排布式为1s22s22p63s23p63d34s2。该元素位于元素周期表
A. 第4周期第ⅤB族 B. 第4周期第ⅡA族
C. 第2周期第ⅡB族 D. 第5周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I. 用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。

(1)Al在元素周期表中的位置为______,试剂X的名称______ 。
(2)溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;b. ____________。
II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:
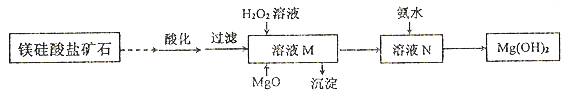
已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
(1)向溶液M中先加入的试剂是_______;产生的沉淀有_____。H2O2参与反应的离子方程式是____________________。
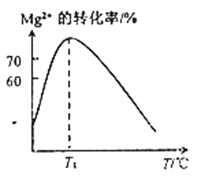
(2)溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg,2+的转化率减小的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载:“烧酒,其法用浓酒和糟入甑,蒸令气上,用器承滴露”,“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可以用于分离()。
A. 甲苯与水 B. 乙醇与水 C. 碘与水 D. 硝酸钾与氯化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com