
| A. | [Na+]+[H+]=[OH-]+[HS-]+[S2-] | B. | [Na+]>[S2-]>[HS-]>[OH-] | ||
| C. | [Na+]=2[S2-]+2[HS-]+2[H2S] | D. | [Na+]>[HS-]>[S2-]>[OH-] |
分析 A.根据溶液中的电荷守恒分析;
B.Na2S水解生成HS-和OH-,水电离生成OH-;
C.根据物料守恒分析;
D.水解程度一般较小,则[S2-]>[HS-].
解答 解:A.溶液中阳离子所带正电荷的总浓度等于阴离子所带负电荷的总浓度,即[Na+]+[H+]=[OH-]+[HS-]+2[S2-],故A错误;
B.Na2S水解生成HS-和OH-,水电离生成OH-,所以溶液中[OH-]>[HS-],则离子浓度关系为[Na+]>[S2-]>[OH-]>[HS-],故B错误;
C.Na2S溶液中S元素存在三种形式,溶液中的物料守恒为[Na+]=2[S2-]+2[HS-]+2[H2S],故C正确;
D.水解程度一般较小,则[S2-]>[HS-],则[Na+]>[S2-]>[OH-]>[HS-],故D错误.
故选C.
点评 本题考查离子浓度大小的比较,题目难度不大,注意从电荷守恒、物料守恒的角度分析,把握盐类水解的原理.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水能跟氯化铝溶液反应生成氢氧化铝沉淀 | |
| B. | 铵盐受热易分解 | |
| C. | 1mol/L 的氨水可以使酚酞试液变红 | |
| D. | 常温下0.1mol/L的氯化铵溶液的pH为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+Ba2+→BaCO3↓ | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| D. | 2HCO3-+Ba2++2OH-→BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
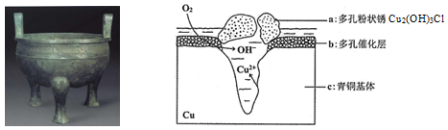
| A. | 青铜器发生电化学腐蚀,图中c作负极,被氧化 | |
| B. | 正极发生的电极反应为O2+4e-+2H2O=4OH- | |
| C. | 环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| D. | 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com