
分析 (1)铝是13号元素,核外电子有13个,每一个电子的运动状态都不同,核外电子排布式为1s22s22p63s23p1 ;有1s、2s、2p、3s、3p能级;
(2)原子晶体,硬度大、熔点高,粒子的电子层越多,粒子的半径越大;
(3)常温下Al的金属性比Ba的金属性弱,该反应是利用Ba的沸点比Al的低;
(4)根据Al(OH)3的酸式电离;根据Al(OH)3的碱式电离平衡以及外界条件对电离平衡的影响;
(5)根据反应物中的元素可知,氧、氟元素位置相邻,则利用非金属性强弱的判断方法来解答;
(6)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒计算Al的物质的量,进而计算Al的质量;氯化铝为共价化合物,晶体中不存在离子,熔融时不能导电.
解答 解:(1)铝是13号元素,核外电子有13个,每一个电子的运动状态都不同,核外电子排布式为1s22s22p63s23p1 ,有5个能级,5种能量不同的电子,
故答案为:13;5;
(2)原子晶体硬度大,熔沸点高,根据氮化硅的物理性质:它的硬度大、熔点高、化学性质稳定,可知属于原子晶体,Al元素原子核外电子数为13,有3个电子层,N元素原子核外电子数为7,有2个电子层,电子层越多半径越大,所以微粒半径大小Al>N,
故答案为:原子;Al>N;
(3)利用元素Ba、Al在元素周期表的位置可知金属活泼性:Al<Ba;但Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行,
故答案为:b;
(4)Al(OH)3的酸式电离:Al(OH)3?H++AlO2-+H2O,同时还存在碱式电离:Al(OH)3?Al3++3OH-,加入盐酸,与OH-反应,碱式电离平衡正向移动,Al3+浓度增大,
故答案为:Al(OH)3?H++AlO2-+H2O;增大;
(5)该反应中的物质含有的元素有Al、O、H、F、Na、C,只有O、F元素相邻,因F的非金属性最强,则没有正价,也就没有最高价氧化物对应水化物,它们也不与酸反应,但可以利用气态氢化物的稳定性和单质与氢气反应的难易来判断O、F非金属性的强弱,
故答案为:ac;
(6)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒,析出Al的物质的量为$\frac{0.6mol}{3}$=0.2mol,故析出Al的质量为0.2mol×27g/mol=5.4g,因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电,
故答案为:阴;5.4;因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电.
点评 本题考查Al、N、F及其化合物的结构性质等,侧重于原子核外电子排布、同主族、同周期元素性质的递变规律的考查,注意氯化铝为共价化合物,为易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有原子个数为0.3NA | B. | 分子个数约为6.02×1022 | ||
| C. | 物质的量是0.2mol | D. | 与质量相等的O2所含原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | |
| B. | 乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 | |
| C. | 打开汽水瓶盖,即有大量气泡逸出 | |
| D. | 配置FeCl3溶液时,加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | HSO3- | C. | AlO2- | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
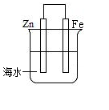
| A. | 此装置属于原电池 | |
| B. | 此装置中电子从铁经导线流向锌 | |
| C. | 此装置中的铁极上发生还原反应 | |
| D. | 该电化学防护法称为“牺牲阳极阴极保护法” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Na+]+[H+]=[OH-]+[HS-]+[S2-] | B. | [Na+]>[S2-]>[HS-]>[OH-] | ||
| C. | [Na+]=2[S2-]+2[HS-]+2[H2S] | D. | [Na+]>[HS-]>[S2-]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 在平衡移动时正反应速率先减小后增大 | |
| D. | 在平衡移动时逆反应速率先增大后减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com