
【题目】下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
A | Mg | 0.1 | 6molL﹣1硝酸 | 10mL | 60℃ |
B | Mg | 0.1 | 3molL﹣1盐酸 | 10mL | 60℃ |
C | Fe | 0.1 | 3molL﹣1盐酸 | 10mL | 60℃ |
D | Mg | 0.1 | 3molL﹣1硫酸 | 10mL | 60℃ |
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应都表示为2H2+O2=2H2O。酸式氢氧燃料电池的电解质溶液是酸溶液,其负极反应可表示为2H24e=4H+,则其正极反应表示为______________________________;碱式氢氧燃料电池的电解质溶液是碱溶液,其正极反应表示为O2+2H2O+4e=4OH,则其负极反应可表示为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某元素在化学反应中由化合态变为游离态,则该元素可能被还原
B.金属原子失电子越多,还原性越强
C.强电解质溶液的导电能力一定比弱电解质强
D.NaHSO4在水溶液中电离时生成的阳离子有氢离子,所以是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是氮循环的一部分: 
(1)通常状况下,NO2的颜色是;
(2)反应①的化学方程式是;
(3)NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;
(4)化合物A的化学式是;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化: 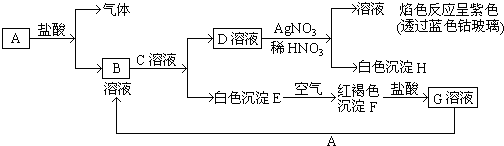
试回答:
(1)写出B的化学式D的化学式 .
(2)写出由E转变成F的化学方程式 .
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法,不正确的是

A. 甲图四种化合物中“0”内A所对应含义的解释有一个是错误的
B. 硝化细菌体内含有甲图中的四种化合物
C. 若乙图表示某种酶在不同温度下催化某反应的效果图,则温度a>b>c
D. 若乙图表示不同浓度的某种酶催化某反应的效果图,则酶浓度a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、A12O3和Fe2O3等,回收其中镁的工艺流程如下:

沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH 由见上表
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_____________________(要求写出两条)
(2)滤渣I的主要成分有_________________________。
(3)从滤液II中可回收利用的主要物质有________________________。
(4)若最终得到的氯化镁溶液中,c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1 ,此时是否有Mg3(PO4)2沉淀生成?_______(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(5) Mg (C1O3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl已知四种化合物的溶解度(S) 随温度(T) 变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg (ClO3)2。简述可制备Mg (ClO3)2的原因:_______________________。
②按①中条件进行制备实验。在冷却降温析出Mg (ClO3)2过程中,常伴有NaCl 析出,原因是:__________。除去产品中该杂质的方法是:___________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com