
����Ŀ��ij����������ɰ�����в����Ĺ�����ϣ���Ҫ����MgCO3��MgSiO3��CaMg(CO3)2��A12O3��Fe2O3�ȣ���������þ�Ĺ�����������:

������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
����������������������ʽ��ȫ���ʱ��Һ��pH �ɼ��ϱ�
��1���������������У�Ϊ���þ�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ��_____________________(Ҫ��д������)
��2������I����Ҫ�ɷ���_________________________��
��3������ҺII�пɻ������õ���Ҫ������________________________��
��4�������յõ����Ȼ�þ��Һ�У�c(Mg2+)=0.02 mol��L-1������˫��ˮ������(����Һ�������1��)��ʹFe3+ǡ�ó�����ȫ����Һ��c(Fe3+)=1.0��10-5 mol��L-1 ����ʱ�Ƿ���Mg3(PO4)2��������?_______(��ʽ����)��FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ1.3��10-22��1.0��10-24��
��5�� Mg (C1O3)2��ũҵ�Ͽ�������Ҷ������������ɲ��ø��ֽⷴӦ�Ʊ�: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl��֪���ֻ�������ܽ��(S) ���¶�(T) �仯��������ͼ��ʾ: �ٽ���Ӧ�ﰴ��ѧ��Ӧ����ʽ�������Ȼ���Ʊ�Mg (ClO3)2���������Ʊ�Mg (ClO3)2��ԭ��:_______________________��
�ڰ��������������Ʊ�ʵ�顣����ȴ��������Mg (ClO3)2�����У�������NaCl ������ԭ����:__________����ȥ��Ʒ�и����ʵķ�����:___________________________________________��

���𰸡� �ʵ���߷�Ӧ�¶ȡ����衢���ӽ���ʱ�䡢���˺�����Һ�мӹ���ϡ���ᣨ��ν�ȡ�� Al��OH)3��Fe��OH)3 Na2SO4 Fe3+ǡ�ó�����ȫʱ��c(PO43-)=![]() mol��L1=1.3��10�C17 mol��L1��c3(Mg2+)��c2(PO43-)��(0.01)3��(1.3��10�C17)2=1.7��10�C40��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2���� ��ijһ�¶�ʱ��NaCl���ȴﵽ����������Mg��ClO3)2���ܽ�����¶ȵı仯���NaCl�ܽ�����������ʵ��ܽ����һ����� ����ǰ����Һ��NaCl�ѱ��ͣ����¹����У�NaCl�ܽ�Ƚ��ͣ����������� �ؽᾧ
mol��L1=1.3��10�C17 mol��L1��c3(Mg2+)��c2(PO43-)��(0.01)3��(1.3��10�C17)2=1.7��10�C40��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2���� ��ijһ�¶�ʱ��NaCl���ȴﵽ����������Mg��ClO3)2���ܽ�����¶ȵı仯���NaCl�ܽ�����������ʵ��ܽ����һ����� ����ǰ����Һ��NaCl�ѱ��ͣ����¹����У�NaCl�ܽ�Ƚ��ͣ����������� �ؽᾧ
��������MgCO3��MgSiO3��CaMg(CO3)2��Al2O3��Fe2O3�������ᷴӦ��������MgSO4��CaSO4��Al2(SO4)3��Fe2(SO4)3��H2SiO3������CaSO4�ܡ�H2SiO3���ܣ��γ���������Һ�к���MgSO4��Al2(SO4)3��Fe2(SO4)3������Һ�м���NaOH��Һ������pH��5.5ʱ��Fe3+��Al3+�Ѿ���ȫ����������I����Ҫ�ɷ���Fe(OH)3��Al(OH)3����Һ�к���MgSO4��Na2SO4������Һ�м���NaOH��������Һ��pHΪ12.5��þ��������Mg(OH)2���������˵õ���ҺNa2SO4��Һ������������þ���پ���һϵ�з�Ӧ�õ��Ȼ�þ��
(1)�������������У������¶ȡ����衢����Ӧ��Ӵ�ʱ�䶼�����þ�Ľ����ʣ�����Ϊ�����þ�Ľ�ȡ�ʣ����Բ��������¶ȡ����衢��ν�ȡ�ȷ������ʴ�Ϊ�������¶ȡ����衢��ν�ȡ�ȣ�
(2)����I�����ӡ��������γɵ����������������������I�ijɷ�ΪFe(OH)3 Al(OH)3���ʴ�Ϊ��Fe(OH)3 Al(OH)3��
(3)����Һ���е����ʺ��������ƣ����Կ��Ի������õ�����ΪNa2SO4���ʴ�Ϊ��Na2SO4��
(4)Fe3+ǡ�ó�����ȫ����Һ��c(Fe3+)=1.0��10-5����Ksp(FePO4)����֪c(PO43-)=![]() =1.0��10-17mol/L��Qc[Mg3(PO4)2]=(
=1.0��10-17mol/L��Qc[Mg3(PO4)2]=( ![]() )3��(1.0��10-17mol/L)2=1.7��10-40��Ksp=1.0��10-24�����������ɣ��ʴ�Ϊ��Fe3+ǡ�ó�����ȫʱ��Qc[Mg3(PO4)2]��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2������
)3��(1.0��10-17mol/L)2=1.7��10-40��Ksp=1.0��10-24�����������ɣ��ʴ�Ϊ��Fe3+ǡ�ó�����ȫʱ��Qc[Mg3(PO4)2]��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2������
(5)�ٷ�ӦMgCl2+2NaClO3�TMg(ClO3)2+2NaCl�����ں�°��Ƽ����NaHCO3��ԭ������ΪNaCl�ܽ��С������Һ��������ʹ��Ӧ������Mg(ClO3)2�ķ�����У��ʴ�Ϊ����ijһ�¶�ʱ��NaCl���ȴﵽ����������Mg(ClO3)2���ܽ�����¶ȵı仯���NaCl�ܽ�����������ʵ��ܽ����һ�����
���ڽ��µĹ����У�Mg(ClO3)2���ܽ�Ȳ��ϼ�С������Һ����������ͬ�¶�ʱ�Ȼ��Ƶ��ܽ����С���������ȴ��������Mg(ClO3)2������һ���������Ȼ��ƣ�����������Mg(ClO3)2�Ĺ�����NaClҲ�������ɣ�ͨ���ᾧ���ؽᾧ�ķ����ᴿ�������壻�ʴ�Ϊ������ǰ����Һ��NaCl�ѱ��ͣ����¹����У�NaCl�ܽ�Ƚ��ͣ��������������ؽᾧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±����Ǹ��鷴Ӧ�ķ�Ӧ����¶ȣ���Ӧ�տ�ʼʱ���ų�H2���������ǣ�������
��������ĩ״��/mol | ���Ũ�ȼ���� | ��Ӧ�¶� | |||
A | Mg | 0.1 | 6molL��1���� | 10mL | 60�� |
B | Mg | 0.1 | 3molL��1���� | 10mL | 60�� |
C | Fe | 0.1 | 3molL��1���� | 10mL | 60�� |
D | Mg | 0.1 | 3molL��1���� | 10mL | 60�� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaNO3)�ǹ�ҵ�ε���Ҫ�ɷ֣���Ư�ס���Ƶȷ���Ӧ�ù㷺����֪: �����£�2NO+Na2O2= =2NaNO2����ľ̿��Ũ���ᡢNa2O2Ϊ��Ҫԭ���Ʊ��������Ƶ�װ����ͼ��ʾ��(���ּг�װ������ȥ)����˵����ȷ����
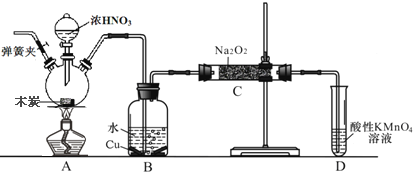
A. ʵ�鿪ʼǰ����װ����ͨ��N2��ʵ�����ʱ��ֹͣͨ��N2��Ϩ��ƾ���
B. ���Խ�B��ҩƷ����NaOH ��Һ
C. Ӧ��B��C֮���һ��ʢ�ż�ʯ�ҵĸ����
D. Dװ������β������������£�ÿ����11.2L��β������0.2mol �ĸ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ����ͨ�������ַ���:���ù��������������Ȼ�粒��ȣ����ڳ������ù�������������Ũ��ˮ��ϡ�
��1����������ȡ�����Ļ�ѧ����ʽΪ_______��������Ӧѡ�õ�______________(����A������B��)��
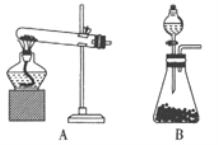
��2�����Ҫ��ø���İ���,Ӧѡ�õĸ������_________
A.Ũ���� B.��ʯ�� C.����������
��3���ռ�����Ӧʹ��_________����
��4��������ͼ��ʾ��Ȫʵ��ʱ���ϲ���ƿ���ѳ��������NH3,������Ȫ�IJ�����______
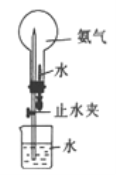
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1����ͬ�����£����֮��Ϊa��b������֮��Ϊa��b��H2��O2�Ļ�����壬��ƽ����Է�������Ϊ�� ��
��2����֪�����ʲμӷ�Ӧ�����ʵ���֮�ȵ������ڻ�ѧ����ʽ�еļ�����֮�ȣ����廯����A�ķ���ʽ�ɱ�ʾΪOxFy �� ͬ��ͬѹ�£�10mLA���ȷֽ�����15mLO2��10mLF2 �� ��A�Ļ�ѧʽΪ �� �ƶϵ�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ����������ίԱ����ȷ����116��Ԫ��Lv������Ϊ�W������![]() �������������
�������������
A. ԭ������116 B. ������177 C. ���������116 D. ���ԭ������293
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2) ����������(SOCl2) ������Ҫ�Ļ����Լ�����ˮ�������ҷ�Ӧ����������ˮ����
��֪:��SO2Cl2 (g)![]() SO2(g)+Cl2(g) ��H= +471.7kJ/mol; ƽ�ⳣ��K1
SO2(g)+Cl2(g) ��H= +471.7kJ/mol; ƽ�ⳣ��K1
��SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) ��H=-477.3kJ/mol; ƽ�ⳣ�� K2
2SOCl2(g) ��H=-477.3kJ/mol; ƽ�ⳣ�� K2
��1����Ӧ2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)��ƽ�ⳣ��K=_____(��K1��K2��ʾ) �÷�Ӧ��H=_____kJ/mol��
SO2Cl2(g)+SCl2(g)��ƽ�ⳣ��K=_____(��K1��K2��ʾ) �÷�Ӧ��H=_____kJ/mol��
��2�����ھ��ȡ����ݵ��ܱ������У�Ͷ��һ������SO2Cl2(g)��SCl2(g)��������ӦSO2Cl2(g)+SCl2(g)![]() 2SOCl2(g)������ʾ��ͼ��˵��t1ʱ�̷�Ӧ�ﵽƽ��״̬����____(�����)��
2SOCl2(g)������ʾ��ͼ��˵��t1ʱ�̷�Ӧ�ﵽƽ��״̬����____(�����)��

��3��Ϊ�о���ͬ�����Է�Ӧ�ٵ�Ӱ�죬�ں��������£���2L�����ܱ������м���0.2molSO2Cl2��10min��Ӧ�ٴﵽƽ�⡣���10min��v(SO2)= 8.0��10-3mo1��L-1��min-1����ƽ��ʱSO2Cl2��ת���ʦ�1=_______���������������ֲ��䣬��Ӧ���ں�ѹ�����½��У�ƽ��ʱSO2Cl2��ת���ʦ�2_____��1���>������<����=��������Ҫ����SO2Cl2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��______(�о�һ��)��
��4�����������(Li/SOCl2) �����һ�ִ�������أ��õ�������ʯī���缫���ϣ��������Һ�������Ȼ����(LiAlCl4) �ܽ�����������(SOCl2)���γɵģ������ܷ�Ӧ����ʽΪ:8Li+3SOCl2��6LiCl+Li2SO3+2S��
��д����ع���ʱ�����ĵ缫��Ӧʽ_____________��
�����ô˵������Դ���Բ����缫���200mL 0.2mol.L-1CuSO4��Һ����������������״����896mL������ʱ����ظ�������﮵�������______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(Na2S2O3) ��һ�ֳ��õĻ���ԭ�ϣ��������������ȡ��ش��������⡣
��1�����������������������Ҫԭ���������______�ԡ�
��2�������������������ѧ��������Ϊ_________��
��3����������������Ի������Һ���ȶ�����������Һ�в��ȶ�����pH=2�������еμ�Na2S2O3��Һ���ɹ۲쵽��������_______________��
��4�������������Һ�������ԡ������ӷ���ʽ������������Ե�ԭ��__________��25��ʱ�����ӷ�Ӧ��ƽ�ⳣ��ֵԼΪ_________��[��֪25��ʱ��K1(H2S2O3)=2.52��10-1��K2(H2S2O3)=1.00��10-2]
��5����ҵ�����У�һ�㽫Na2S��Na2CO3�����ʵ�����2 :1��ɻ����Һ�������ƻ����Һǰ�Ƚ�����ˮ�������һ��ʱ�����ã��ٽ�SO2����ͨ����Һ�У����ɵ������������
��������ˮ�������һ��ʱ�����ã���Ŀ����_________��
����Ӧ�Ļ�ѧ����ʽΪ__________��
����֪��2Na2S2O3+I2= 2NaI+Na2S4O6��Ϊ�ⶨ���Ƶþ���Ĵ�������С���Ե�����ָʾ������0.010mol/L�ĵ�ˮ���ж��ȡ���ζ������Na2S2O3��5H2O �ĺ���ԼΪ102%���������Լ��������������������ý������ܵ�ԭ����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ,����˵����ȷ���ǡ�(�� )
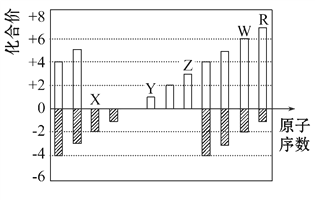
A. ԭ�Ӱ뾶:Z>Y>X
B. ��̬�⻯����ȶ���: W>R
C. WX3��ˮ��Ӧ�γɵĻ��������H2WO3
D. Y��Z��������������Ӧ��ˮ���������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com