
【题目】实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水混合。
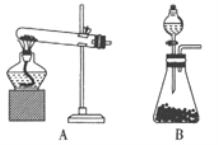
(1)方法①制取氨气的化学方程式为_______,方法②应选用的______________(填“A”或“B”)。
(2)如果要获得干燥的氨气,应选用的干燥剂是_________
A.浓硫酸 B.碱石灰 C.五氧化二磷
(3)收集氨气应使用_________法。
(4)进行下图所示喷泉实验时,上部烧瓶中已充满干燥的NH3,引发喷泉的操作是______
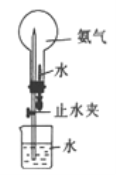
【答案】 NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O B B 向下排空气 打开止水夹,挤压胶头滴管
CaCl2+2NH3↑+2H2O B B 向下排空气 打开止水夹,挤压胶头滴管
【解析】(1)方法①制取NH3的反应为加热NH4Cl和Ca(OH)2 反应生成氯化钙、氨气和水,反应的化学方程式为:NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;方法②在常温下用固体氢氧化钠与浓氨水反应是固体和液体不加热制备气体。应选择B装置;(3)A.浓硫酸和氨气反应生成硫酸铵,不能干燥氨气,选项A错误;B.固体氢氧化钠具有吸湿性,可以干燥氨气,选项B正确;C.五氧化二磷和氨气发生反应,不能干燥氨气,选项C错误;答案选B;(3)氨气极易溶于水不能用排水法收集,氨气密度比空气小,收集氨气应使用向下排空气法收集;(4)进行右图所示喷泉实验时,上部烧瓶中已充满干燥的NH3,引发喷泉的操作是打开止水夹,挤压胶头滴管。
CaCl2+2NH3↑+2H2O;方法②在常温下用固体氢氧化钠与浓氨水反应是固体和液体不加热制备气体。应选择B装置;(3)A.浓硫酸和氨气反应生成硫酸铵,不能干燥氨气,选项A错误;B.固体氢氧化钠具有吸湿性,可以干燥氨气,选项B正确;C.五氧化二磷和氨气发生反应,不能干燥氨气,选项C错误;答案选B;(3)氨气极易溶于水不能用排水法收集,氨气密度比空气小,收集氨气应使用向下排空气法收集;(4)进行右图所示喷泉实验时,上部烧瓶中已充满干燥的NH3,引发喷泉的操作是打开止水夹,挤压胶头滴管。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应都表示为2H2+O2=2H2O。酸式氢氧燃料电池的电解质溶液是酸溶液,其负极反应可表示为2H24e=4H+,则其正极反应表示为______________________________;碱式氢氧燃料电池的电解质溶液是碱溶液,其正极反应表示为O2+2H2O+4e=4OH,则其负极反应可表示为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法,不正确的是

A. 甲图四种化合物中“0”内A所对应含义的解释有一个是错误的
B. 硝化细菌体内含有甲图中的四种化合物
C. 若乙图表示某种酶在不同温度下催化某反应的效果图,则温度a>b>c
D. 若乙图表示不同浓度的某种酶催化某反应的效果图,则酶浓度a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知: N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=﹣534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
A.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣542.7 kJ/mol
B.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1059.3 kJ/mol
C.N2H4(g)+ ![]() N2O4(g)═
N2O4(g)═ ![]() N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z、T 的原子序数依次增大,由这五种元素组成一种复盐(含2 种阳离子和1种阴离子的盐) M。M 中阳离子和阴离子总数相等。取少量M 溶于水,将所得溶液分成两份:一份滴加氯化钡溶液和盐酸,产生白色沉淀;另一份滴加氢氧化钠溶液,先产生白色沉淀,继续滴加则白色沉淀消失,反应过程中产生有刺激性气味的气体。下列说法正确的是
A. R、X 可以形成X2R4,电子式为![]()
B. 气态氢化物的稳定性: XH3>H2Y>H2T
C. Y 和Z形成的氧化物常作为除去A1Cl3溶液中少量的Fe3+的沉淀剂
D. M 的水溶液中离子浓度大小排序为:c(SO42-) >c(Al3+) > c(NH4+) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B的作用是_________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:_________________________________;
②使用________(填仪器名称)准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、A12O3和Fe2O3等,回收其中镁的工艺流程如下:

沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH 由见上表
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_____________________(要求写出两条)
(2)滤渣I的主要成分有_________________________。
(3)从滤液II中可回收利用的主要物质有________________________。
(4)若最终得到的氯化镁溶液中,c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1 ,此时是否有Mg3(PO4)2沉淀生成?_______(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(5) Mg (C1O3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl已知四种化合物的溶解度(S) 随温度(T) 变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg (ClO3)2。简述可制备Mg (ClO3)2的原因:_______________________。
②按①中条件进行制备实验。在冷却降温析出Mg (ClO3)2过程中,常伴有NaCl 析出,原因是:__________。除去产品中该杂质的方法是:___________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂。有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水.易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水。 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
实验室可以用多种方法来制备无水FeCl2,回答下列问题:
I.按如图l装置用H2还原无水FeCl3制取,装置C的作用是_________;E中盛放的试剂是_________;D中反应的化学方程式为_________。

II.按如图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128—139℃加热3h,反应接近100%。冷却,分离提纯得到粗产品。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HC1
(1)该制取反应中,作还原剂的是_________。
(2)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是_________。
(3)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。
①洗涤所用的试剂可以是_________;
②回收滤液中C6H5Cl的方法是_________。
(4)仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中试剂可以是加有酚酞,且理论上含_________g NaOH的溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com