
【题目】FeCl2是一种常用的还原剂。有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水.易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水。 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
实验室可以用多种方法来制备无水FeCl2,回答下列问题:
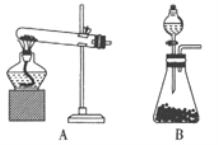
I.按如图l装置用H2还原无水FeCl3制取,装置C的作用是_________;E中盛放的试剂是_________;D中反应的化学方程式为_________。

II.按如图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128—139℃加热3h,反应接近100%。冷却,分离提纯得到粗产品。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HC1
(1)该制取反应中,作还原剂的是_________。
(2)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是_________。
(3)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。
①洗涤所用的试剂可以是_________;
②回收滤液中C6H5Cl的方法是_________。
(4)仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中试剂可以是加有酚酞,且理论上含_________g NaOH的溶液。
【答案】 干燥氢气 碱石灰 H2+2FeCl3![]() 2FeCl2+2HC1 C6H5Cl 实验使用了冷凝回流装置 苯 蒸馏滤液,并收集132℃馏分 18
2FeCl2+2HC1 C6H5Cl 实验使用了冷凝回流装置 苯 蒸馏滤液,并收集132℃馏分 18
【解析】本题主要考查FeCl2的实验室制法。
I.按如图l装置用H2还原无水FeCl3制取,装置C的作用是干燥氢气;E中盛放的试剂是碱石灰,防止空气中的水蒸气进入D装置;D中反应的化学方程式为H2+2FeCl3![]() 2FeCl2+2HC1。
2FeCl2+2HC1。
II.(1)该制取反应中,FeCl3是氧化剂,作还原剂的是C6H5Cl。
(2)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是实验使用了冷凝回流装置。
(3)①C6H5Cl、C6H4Cl2易溶于苯,FeCl2不溶于苯,洗涤所用的试剂可以是苯;
②分离互溶液体的一般方法是蒸馏,回收滤液中C6H5Cl的方法是蒸馏滤液,并收集132℃馏分。
(4)162.5g无水氯化铁的物质的量是1mol,氯化铁转化率达到或超过90%,生成氯化氢的物质的量不少于0.45mol,烧杯中的酚酞在氢氧化钠耗尽时由红色变为无色,理论上与0.45molHCl发生反应消耗0.45mol即18gNaOH。


科目:高中化学 来源: 题型:
【题目】实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水混合。
(1)方法①制取氨气的化学方程式为_______,方法②应选用的______________(填“A”或“B”)。
(2)如果要获得干燥的氨气,应选用的干燥剂是_________
A.浓硫酸 B.碱石灰 C.五氧化二磷
(3)收集氨气应使用_________法。
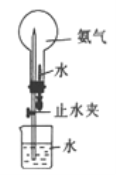
(4)进行下图所示喷泉实验时,上部烧瓶中已充满干燥的NH3,引发喷泉的操作是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3) 是一种常用的化工原料,常用作除氧剂等。回答下列问题。
(1)硫代硫酸钠做除氧剂的主要原因是其具有______性。
(2)硫代硫酸纳中所含化学键的类型为_________。
(3)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是_______________。
(4)硫代硫酸纳溶液呈弱碱性。用离子方程式解释其呈弱碱性的原因__________;25℃时该离子反应的平衡常数值约为_________。[已知25℃时,K1(H2S2O3)=2.52×10-1,K2(H2S2O3)=1.00×10-2]
(5)工业生产中,一般将Na2S和Na2CO3以物质的量比2 :1配成混合溶液,在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,再将SO2缓缓通入溶液中,即可得硫代硫酸钠。
①将蒸馏水加热煮沸一段时间后待用,其目的是_________。
②反应的化学方程式为__________。
③已知:2Na2S2O3+I2= 2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L的碘水进行多次取样滴定,测得Na2S2O3·5H2O 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( ) 
A.和金属钠作用时,键①断裂
B.燃烧是全部化学键都断裂
C.在铜催化下和氧气反应时,键①和③断裂
D.和乙酸、浓硫酸共热时,键②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是

A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示. 则反应:A(g)+B(g)=2C(g)( )
A.是放热反应
B.反应后气体总分子数增多
C.是吸热反应
D.反应物具有的总能量等于生成物具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是 ( )
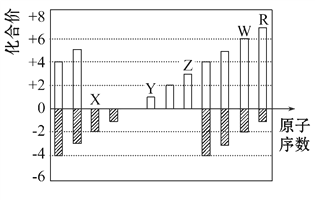
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性: W>R
C. WX3和水反应形成的化合物的是H2WO3
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空: (i)所需浓H2SO4的体积为(用下一小题的仪器量取).
(ii)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
(iii)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌.
(iv)将的上述溶液沿玻璃棒注入中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀.
(v)加水至距刻度线1﹣2cm时,改用加水,使溶液凹液面跟刻度相平.
(vi)用“偏高”“偏低”或“无影响”填空:
①定容时,观察液面俯视:;
②摇匀后,液面低于刻度线,没有再加水:;
③取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),△H=﹣1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
A.
B.
C.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com