
【题目】乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( ) 
A.和金属钠作用时,键①断裂
B.燃烧是全部化学键都断裂
C.在铜催化下和氧气反应时,键①和③断裂
D.和乙酸、浓硫酸共热时,键②断裂
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知: N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=﹣534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
A.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣542.7 kJ/mol
B.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1059.3 kJ/mol
C.N2H4(g)+ ![]() N2O4(g)═
N2O4(g)═ ![]() N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 80℃时,1L pH=l的硫酸溶液中,含有的OH-数目为10-13NA
B. 向含有FeI2的溶液中通人适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
C. l00g质量分数为46%的乙醇水溶液中氧原子数为4NA
D. 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图示. 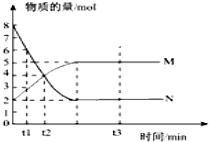
(1)此反应的化学方程式中a:b=
(2)t1到t2时刻,以M的浓度变化表示的平均化学反应速率为
(3)此反应在该条件下达到限度时,反应物的转化率为
(4)下列叙述中能说明上述反应达到平衡状态的是 A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗amol N,同时生成bmol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂。有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水.易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水。 | ||
熔点/℃ | -45 | 53 | —— | —— |
沸点/℃ | 132 | 173 | —— | —— |
实验室可以用多种方法来制备无水FeCl2,回答下列问题:
I.按如图l装置用H2还原无水FeCl3制取,装置C的作用是_________;E中盛放的试剂是_________;D中反应的化学方程式为_________。

II.按如图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128—139℃加热3h,反应接近100%。冷却,分离提纯得到粗产品。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HC1
(1)该制取反应中,作还原剂的是_________。
(2)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是_________。
(3)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。
①洗涤所用的试剂可以是_________;
②回收滤液中C6H5Cl的方法是_________。
(4)仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中试剂可以是加有酚酞,且理论上含_________g NaOH的溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。
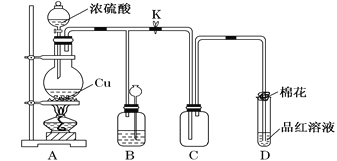
(1)装置A中发生反应的化学方程式为_____________________________________
(2)装置D中试管口放置的棉花应浸一种溶液,这种溶液是________,其作用是____________________________________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_______________________,B中应放置的溶液是________。
a.水 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟产业被称为“信息时代的朝阳产业”.元素周期表中铟的数据如图,下列说法完全正确的是( )
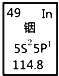
A. 铟元素的质量数是114.8
B. 铟元素的相对原子质量是114
C. 铟元素是一种副族元素
D. 铟原子核外有49个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com