
【题目】下列过程中,属于化学变化的是
A.用加热法分离泥沙中的碘单质B.用蒸馏法制取蒸馏水
C.干冰气化D.铁锅生锈
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
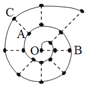
A. 原子半径大小顺序:r (B)>r(C)>r(A)
B. B、C最高价氧化物之间可以相互反应
C. A、C 形成的简单氢化物的稳定性差异是由于氢键作用力较强
D. 虚线相连的元素处于同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;②在常温下用固体氢氧化钠与浓氨水混合。
(1)方法①制取氨气的化学方程式为_______,方法②应选用的______________(填“A”或“B”)。
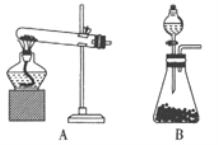
(2)如果要获得干燥的氨气,应选用的干燥剂是_________
A.浓硫酸 B.碱石灰 C.五氧化二磷
(3)收集氨气应使用_________法。
(4)进行下图所示喷泉实验时,上部烧瓶中已充满干燥的NH3,引发喷泉的操作是______
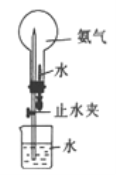
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A.复分解反应中有的是氧化还原反应,有的不是氧化还原反应
B.置换反应有可能是非氧化还原反应
C.化合反应一定是氧化还原反应
D.分解反应不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3) 是一种常用的化工原料,常用作除氧剂等。回答下列问题。
(1)硫代硫酸钠做除氧剂的主要原因是其具有______性。
(2)硫代硫酸纳中所含化学键的类型为_________。
(3)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是_______________。
(4)硫代硫酸纳溶液呈弱碱性。用离子方程式解释其呈弱碱性的原因__________;25℃时该离子反应的平衡常数值约为_________。[已知25℃时,K1(H2S2O3)=2.52×10-1,K2(H2S2O3)=1.00×10-2]
(5)工业生产中,一般将Na2S和Na2CO3以物质的量比2 :1配成混合溶液,在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,再将SO2缓缓通入溶液中,即可得硫代硫酸钠。
①将蒸馏水加热煮沸一段时间后待用,其目的是_________。
②反应的化学方程式为__________。
③已知:2Na2S2O3+I2= 2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L的碘水进行多次取样滴定,测得Na2S2O3·5H2O 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( ) 
A.和金属钠作用时,键①断裂
B.燃烧是全部化学键都断裂
C.在铜催化下和氧气反应时,键①和③断裂
D.和乙酸、浓硫酸共热时,键②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空: (i)所需浓H2SO4的体积为(用下一小题的仪器量取).
(ii)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
(iii)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌.
(iv)将的上述溶液沿玻璃棒注入中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀.
(v)加水至距刻度线1﹣2cm时,改用加水,使溶液凹液面跟刻度相平.
(vi)用“偏高”“偏低”或“无影响”填空:
①定容时,观察液面俯视:;
②摇匀后,液面低于刻度线,没有再加水:;
③取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com