
 xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

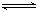 4NO(g)��6H2O(g)���SH= -808.7KJ/mol
4NO(g)��6H2O(g)���SH= -808.7KJ/mol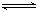 NO2(g)��NO(g)���SH= +41.8kJ/mol
NO2(g)��NO(g)���SH= +41.8kJ/mol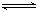 2HNO3(l)��NO(g)���SH= -261.3kJ/mol
2HNO3(l)��NO(g)���SH= -261.3kJ/mol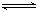 2CO(g)���SH= +171.4kJ/mol
2CO(g)���SH= +171.4kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)��2D(g)���������ʵ�����A��B�����2 L���ܱ������У���5 min��ﵽ��ѧƽ�⣬��ʱ���D��Ũ��Ϊ0.5 mol/L����c(A)��c(B)��3��5����֪5 min ����C��ʾ��ƽ����Ӧ����Ϊ0.1 mol/(L��min)����
xC(g)��2D(g)���������ʵ�����A��B�����2 L���ܱ������У���5 min��ﵽ��ѧƽ�⣬��ʱ���D��Ũ��Ϊ0.5 mol/L����c(A)��c(B)��3��5����֪5 min ����C��ʾ��ƽ����Ӧ����Ϊ0.1 mol/(L��min)���� ________mol/(L��min)��
________mol/(L��min)�� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g) ��H = QKJ/mol
xC(g) ��H = QKJ/mol xc(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2 ��
xc(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2 ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3����Ӧ���е�2minʱ�������������2molN2����
2NH3����Ӧ���е�2minʱ�������������2molN2�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OH(g)��H2O(g) ��H����49.0 kJ��mol-1
CH3OH(g)��H2O(g) ��H����49.0 kJ��mol-1| ʱ�� | c��H2����mol��L-1 | c��CH3OH����mol��L-1 | v��������v���棩 �Ƚ� |
| t0 | 6 | 0 | �� |
| t1 | 3 | 1 | v������=v���棩 |
| A��t0��t1ʱ������(H2)��3 /��t1 - t0�� mol��(L��min)-1 |
| B��t1ʱ���������¶Ȼ��ٳ���CO2���壬���������H2��ת���� |
| C��t0ʱ��v��������v���棩 |
| D��T ��ʱ��ƽ�ⳣ��K = 1/27��CO2��H2��ת������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 NO2 ��H>0��Ӧ�У�������30���100��ʱƽ����ϵ��NO�İٷֺ����뷴Ӧ��ϵ��ѹǿp�Ĺ�ϵ����ͼ�е�
NO2 ��H>0��Ӧ�У�������30���100��ʱƽ����ϵ��NO�İٷֺ����뷴Ӧ��ϵ��ѹǿp�Ĺ�ϵ����ͼ�е�
|
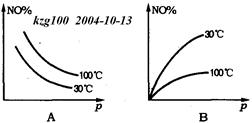
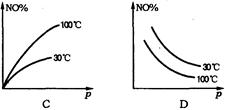
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
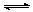 2NH3���÷�Ӧ�ﵽƽ��ı�־��
2NH3���÷�Ӧ�ﵽƽ��ı�־��| A��3v(H2)��=2v(NH3)�� | B����λʱ������m mol N2��ͬʱ����3m mol H2 |
| C�����������ܶȲ�����ʱ��仯 | D�������ڵ���ѹǿ������ʱ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
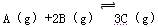 ���ﵽƽ�������1��2 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ2��1 mol��
���ﵽƽ�������1��2 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ2��1 mol���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com