
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝 | |
| D. | 生铁、普通钢和不锈钢中的含碳量依次降低 |
分析 A、铝非常活泼,表面极易形成氧化膜,保防了内部金属;
B、铁离子被还原,得到亚铁离子;
C、铝在氧气中燃烧的现象是产生更为耀眼的强光,放出大量的热,生成灰色固体;
D、生铁的含碳量是2%-4.3%;钢的含碳量是0.03%-2%.
解答 解:A、铝非常活泼,表面极易形成氧化膜,保防了内部金属,故A正确;
B、铁离子被还原,得到亚铁离子,所以金属阳离子被还原不一定得到金属单质,故B正确;
C、铁在氧气中燃烧火星四射,而铝在氧气中燃烧的现象是产生更为耀眼的强光,放出大量的热,生成灰色固体,故C错误;
D、生铁的含碳量是2%-4.3%;钢的含碳量是0.03%-2%,所以生铁、普通钢和不锈钢中的含碳量依次降低,故D正确;
故选C.
点评 本考点主要考查纯金属与合金的性质,铁在氧气中燃烧火星四射,生铁的含量高于铜,考查基础性强,比较好把握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 乙烯是石油裂解后的产物 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
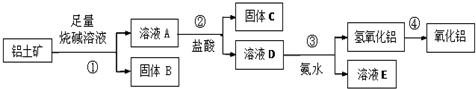
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 |
| (1) | NO | NO2 | ||
| (2) | Fe粉 | Al粉 | ||
| (3) | 氯化钠固体 | 氯化铵固体 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据元素周期表中第四周期元素的相关知识,回答下列问题:
根据元素周期表中第四周期元素的相关知识,回答下列问题: ,CNO-的中心原子的杂化方式为sp.
,CNO-的中心原子的杂化方式为sp.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
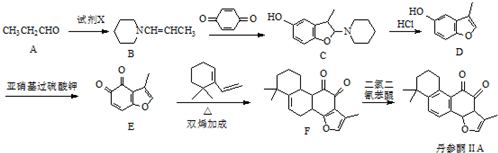
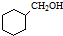
 .
.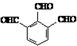 .
. 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 使用资源节约型、环境友好型的生物降解塑料包装袋 | |
| C. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
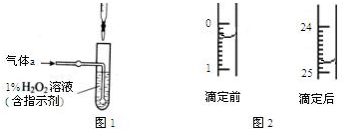
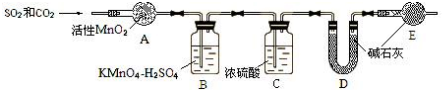
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com