
(10分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2
FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| | 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
 CO(g) + H2O(g) △H,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。 CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。 FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
 增大的是 (填序号)
增大的是 (填序号) 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(10分)(1)反应Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
|
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应 CO2(g) + H2(g)CO(g) + H2O(g) △H ,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g)CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)△H > 0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO2的浓度 mol·L-1。
②下列措施中能使平衡时增大的是 (填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)反应Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
|
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应 CO2(g) + H2(g)CO(g) + H2O(g) △H ,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g)CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)△H > 0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO2的浓度 mol·L-1。
②下列措施中能使平衡时增大的是 (填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)反应Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
|
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应 CO2(g) + H2(g)CO(g) + H2O(g) △H ,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g)CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)FeO(s)+CO(g)△H > 0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO2的浓度 mol·L-1。
②下列措施中能使平衡时增大的是 (填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期化学一轮复习《化学家眼中的物质世界》专题综合测试(苏教版) 题型:填空题
(10分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1
FeO(s)+CO(g) △H1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g)
△H2,平衡常数为K2
FeO(s)+H2(g)
△H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
|
|
700℃ |
900℃ |
|
K1 |
1.47 |
2.15 |
|
K2 |
2.38 |
1.67 |
①反应 CO2(g) + H2(g) CO(g) + H2O(g) △H ,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)
+ H2(g)
CO(g) + H2O(g) △H ,平衡常数K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)
+ H2(g) CO(g) + H2O(g)是
反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是
反应(填“吸热”或“放热”)。
②能判断CO2(g)
+ H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g)
△H > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g)
△H > 0,CO2的浓度与时间的关系如图所示:
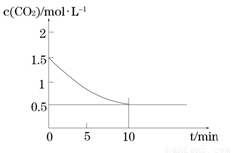
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度 mol·L-1。
②下列措施中能使平衡时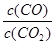 增大的是
(填序号)
增大的是
(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com